Химические свойства
Гликоли обладают всеми свойствами спиртов (образуют алкоголяты, простые и сложные эфиры).
20. Получение. 1. Глицерин можно получать гидролизом (омылением) растительных или животных жиров (в присутствии щелочей или кислот):
Гидролиз в присутствии щелочей приводит к образованию натриевой или калиевой солей высших кислот — мыла (поэтому этот процесс называется омылением).
2. Синтез из пропилена (промышленный способ)
Химические свойства. По химическим свойствам глицерин во многом напоминает этиленгликоль. Он может реагировать одной, двумя или тремя гидроксильными группами.
1. Образование глицератпов. Глицерин, вступая в реакции со щелочными металлами, а также с гидроксидами тяжелых металлов, образует глицераты
2. Образование сложных эфиров. С органическими и минеральными кислотами глицерин образует сложные эфиры
3. Замена гидроксильных групп на галогены. При взаимодействии глицерина с галогеноводородами (НС1, НВr) образуются моно- и дихлор- или бромгидрины
4. Окисление. При окислении глицерина образуются различные продукты, состав которых зависит от природы окислителя. Начальными продуктами окисления являются: глицериновый альдегид HOCH2—CHOH—CHO, дигидроксиацетон НОСН2—СО—CН2ОН и конечный продукт (без разрыва углеродной цепи) — щавелевая кислота НООС—СООН.
21. Получение фенола
Современной промышленности известно несколько способов получения фенола:
1. Кумольный метод получения.
Гидропероксид кумола (ГПК) получают при нормальном (без использования катализаторов) окислении воздухом кумола в каскаде барботажных колонн. А фенол и ацетон получают в ходе разложения ГПК с использованием в качестве катализатора серной кислоты.
2. Получение фенола путем сплавления ароматических сульфокислот с щелочами.
На феноксиды, образованные в результате сплавления ароматических сульфокислот с щелочами, оказывают воздействие сильными кислотами. В результате получаются многоатомные свободные фенолы.
3. Получение фенола путем воздействия на галогенбензолы
Фенолят натрия получают при взаимодействии гидроксида натрия и хлорбензола. Обязательным катализатором в данной реакции является давление. Далее фенолят натрия обрабатывают кислотой.
Химические свойства
1.Слабые кислотные свойства фенола в реакциях с щелочами позволяют образовывать соли группы фенолят.
В результате данной реакции получается фенолят натрия.
2. Еще одним свойством фенола является его способность вступать в реакции замещения по ароматическому кольцу. Он поддается алкилированию, ацилированию, нитрированию, сульфированию и галогенизации.
3. Реакция Кольбе-Шмидта происходит при реакции фенола с металлическим натрием:
4. Реакция взаимодействия с концентрированной азотной кислотой
22. Способы получения:
1. Окисление спиртов
2. В промышлености альдегиды и кетоны получают дегидрированием спиртов, пропуская пары спирта над нагретым катализатором (Cu, соединения Ag, Cr или Zn).
3. Гидратация алкинов (реакция Кучерова)
Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
Кетоны получают при гидратации других гомологов ряда алкинов
4. Окисление алкенов (катализаторы - хлориды Pd и Cu)
5. Кумольный способ получения ацетона (наряду с фенолом).
ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ.
I.Реакции присоединения
1.Присоединение синильной кислоты
2.Присоединение водорода
II.Реакция замещения карбонильного кислорода
1.Взаимодействие с гидроксиламином
2.Взаимодействие с пятихлористого фосфора
Альдегиды — это органические вещества, в молекулах которых углеводородный радикал связан с особой группой атомов — альдегидной группой:
Кетоны — это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
23. Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
Получение карбоновых кислот.
1. Окисление спиртов
2.Окисление альдегидов
20.2.Химические свойства карбоновых кислот.
1.Взаимодействие с металлами
2CH3COOH+Ca(CH3COO)2Ca+H2
2.Взаимодействие с оксидами металлов
2CH3COOH+CaO(CH3COO)2Ca+H2O
3.Реакция нейтрализации
2CH3COOH+Ca(OH)2(CH3COO)2Ca+2H2O
4.Взаимодействие с солями
2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2
5.Действие галогенирующих агентов
6.Реакция этерификации
CH3COOH+HOСH2CH3CH3COOC2H5+H2O
7.Галогенирование кисло
24. Эстеры это сложные эфиры, полученые путем химической реакции между жирными кислотами и спиртами.
Химические свойства сложных эфиров (Слайд 10)
Это достаточно химически инертные вещества.
1. Они хорошо горят, образуя углекислый газ и воду.
2. Подвергаются гидролизу.
Гидролиз – реакция, обратная этерификации, в нейтральной среде он протекает медленно и заметно ускоряется в присутствии кислот или оснований, т.к. ионы Н+и ОН–катализируют этот процесс.
25.
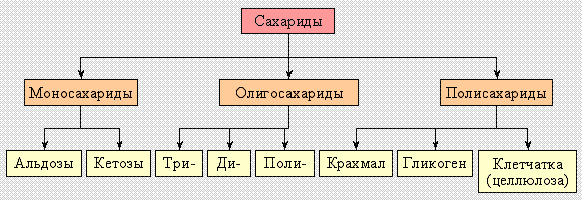
26. Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один, два или три атомаводорода замещены на углеводородные радикалы.
1. Действие аммиака на алкилгалогениды(реакция Гофмана)
2.Восстановление нитросоединений
3.Нагревание амидов кислот с щелочными растворами бромноватистых солей
ХИМИЧЕСКИЕ СВОЙСТВА АМИНОВ.
1.Солеобразование
2.Действие на амины азотистой кислоты
3.Действие на амины азотистой кислоты
27. Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Общие химические свойства
1) Аминокислоты могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы -COOH, так и основные свойства, обусловленные аминогруппой -NH2. Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO-. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
2) Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков и нейлона-6.
3) Изоэлектрической точкой аминокислоты называют pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
4) Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
28. Белки имеют высокую молекулярную массу, растворимы в воде, способны к набуханию, характеризуются химической активностью, подвижностью в электрическомполе и некоторыми другими свойствами. Белки активно вступают в химические реакции.
1. Белки являются высокомолекулярными соединениями.
2. Важнейшим свойством белков является их способность проявлять как кислые, так и основные свойства, т. е. выступать в роли амфотерных электролитов.
3. Важное значение для организма имеет способность белков адсорбировать на своей поверхности некоторые вещества и ионы
4. 4. Водные растворы белков имеют свои особенности. Во-первых, белки обладают большим сродством к воде, т. е. они гидрофильны. Это значит, что молекулы белка, как заряженные частицы, притягивают к себе диполи воды, которые располагаются вокруг белковой молекулы и образуют водную или гидратную оболочку. Эта оболочка предохраняет молекулы белка от склеивания и выпадения в осадок.
Классификация белков
Все белки в зависимости от строения делятся на простые — протеины, состоящие только из аминокислот, и сложные — протеиды, молекулы которых, помимо белковой части, имеют и небелковую — простетическую группу.
Первичная структура белка – последовательность чередования аминокислотных остатков (все связи ковалентные, прочные)
Вторичная структура – форма полипептидной цепи в пространстве. Белковая цепь закручена в спираль (за счет множества водородных связей)
Третичная структура – реальная трехмерная конфигурация, которую принимает в пространстве закрученная спираль (за счет гидрофобных связей), у некоторых белков – S–S-связи (бисульфидные связи)
Четвертичная структура – соединенные друг с другом макромолекулы белков образуют комплекс
 2018-01-21
2018-01-21 299
299






