Билет
1.Тірі ағзалардағы өзара байланыс үздіксіз өтіп жатқан олрасан зор реакциялар жиынтығынан тұратын заттар алмасуын онымен қабат жүретін энергия алмасу процестерінен бөліп қарау мүмкін емес.
Химиялық темодинамика -химиялық энергияның басқа түрге, яғни электрлі, жылу, механикалық және беттік энергияларға айналу заңдылықтарын зерттейтін ғылым саласы
Жүйе -қоршаған ортадан ойша бөлініп алынған және онымен әрекеттесуде болатын дене не денелер тобы.
Термодинамикалық жүйе -қоршаған ортадан шыгайы не шартты түрде бөлінген, немесе өзара әрекеттесуші бірнеше денелер жиынтығы.
Оқшауланған жүйе -қоршаған ортамен энергиясымен де массасымен де алмаспайтын жүйе. М-лы: Бүкіл әлем, термостағы мұз.
Жабық жүйе - қоршаған ортамен энергиясымен алмасып, массасымен алмаспайтын жүйе. М-лы: жер шары, суыған тас.
Ашық жүйе – қоршаған ортамен энергиясымен де массасымен де алмасатын жүйе. М-лы: адамзат, өсімдік, жасуша, беті ашық ыдыстағы ерітінді.
Фаза – жүйенің басқа бөлшектерінен бөліну бетімен шектелген, кез-келген нүктесінді құрамы және қасиеттері бірдей болатын бөлшектер жиынтығы.
Компонент – тепе-теңдік жүйесінің тәуелсіз құрамдас бөлігі.
Жүйенің термодинамикалық тепе-теңдік күйі -уақыт аралығындағы жүйе қасиеттерінің кез-келген нүктедегі тұрақтылығы, энергия және зат алмасу процестерінің болмауы.
Жүйенің стационарлы күйі – қоршаған ортамен үздіксіз энергия көзі мен зат алмасу процестерінің нәтижесінде жүйе қасиеттерінің уақыт аралығындағы тұрақтылығы.
Термодинамикалық параметрлер - термодинамикалық жүйенің күйін сипаттайтын физикалық шамалар: масса (m), зат мөлшері (n), температура (Т), қысым (р), көлем (V), концентрация(C), тығыздығы(ρ), молярлық электрөткізгіштік(λ), ішкі энергия (U), энтальпия(Н), энтропия(S).
Негізгі параметрлер – шамасын тікелей өлшеуге болатын параметрлер. Оларға m, V,T,C жатады.
Экстенсивті параметрлер - шамасы жүйенің өлшеміне тәуелді және термодинамикалық жүйе бөлшектеріне пропорционалды параметрлер. Оларға m, V, n, H, G жатады.
Интенсивті параметрлер – шамасы жүйенің өлшеміне тәуелсіз параметрлер: T, C, λ, ρ.
Жүйе күйінің функциялары – бірден өлшеуге болмайтын, терм-қ жүйенің берілген бір уақыт мезгіліндегі күйін сипаттайтын өзге параметрлердің мәндерін қолдана отырып сәйкес математикалық формулалар арқылы ғана есептеп табылатын параметрлер. Оларға U, H, S, G жатады.
2. Қазіргі кездегі органикалық қосылыстар екі белгі бойынша жіктеледі:
-молекуланың көміртек қаңқасына байланысты
-молекуладағы функ-қ топтардың табиғатына бай-ты.
Органикалық қосылыстар:
1- Ациклд і –алифатты-ашық тізбекті қосылыстар
-қаныққан
-қанықпаған
2- циклді -тұйық тізбекті қосылыстар
- карбоциклді -тұйық тізбек тек көміртек атомынан тұрады.
А)алициклді
Б)ароматты
- гетероциклді – тұйық тізбек көміртек және басқа элементтер атомдарынан тұрады.
Ациклді қосылыстар - тармақталған және тармақталмаған ашық тізбектен тұрады. Ациклді қосылыстар қаныққан және қанықпаған болып екіге бөлінеді.
СН3-СН3 СН2=CН2 СН≡СН СН2=СН-СН=СН2
СН3-СН-СН3 СН3-СН-СН3 СН3-С=СН-СН3 CH3-CH=O
׀ ׀ ׀
СН ОН Сl
Карбоциклдіқосылыстар – тұйық тізбек тек көміртек атомынан тұрады. Карбоциклді қосылыстарға ациклді және ароматты молекулалар жатады.


 Ациклді қосылыстар -тұйық тізбекті қосылыстар (циклоалкандар). Алициклді қосылыстардың қарапайым өкілі –циклопропан.
Ациклді қосылыстар -тұйық тізбекті қосылыстар (циклоалкандар). Алициклді қосылыстардың қарапайым өкілі –циклопропан.
 Циклопропан Циклобутан Циклопентан Циклогексан
Циклопропан Циклобутан Циклопентан Циклогексан
Ароматты қосылыстар – бір немесе бірнеше бензол сақинасынан тұратын тұйықталған қосылыстар. Мысалы: бензол, нафталин, антрацен және олардың тындылары.
 бензол
бензол  нафталин
нафталин  фенантрен
фенантрен
Гетероциклді қосылыстар -тұйық қосылыстар – тұйық тізбек көміртек атомынан және бір немесе бірнеше гетероатомнан (азот, оттек, күкірт) тұрады.

пиримидин
Органикалық қосылыстар құрылысы мен қасиетіне байланысты бірнеше класстарға бөлінеді. Органикалық қосылысты бірнеше кластарға бөледі. Органикалық қосылыстардың ең қарапайым класы көмірсутектер. Көмірсутектердегі сутек атомын басқа атомға немесе атом топтарына алмастырғанда басқа органикалық қосылыстардың кластары пайда болады.
Заттың химиялық өзгерістерінің негізгі бағытын анықтайтын және қандай класқа жататынын сипаттайтын атом немесе атом топтарын фукционалдық топ деп атайды.
Бір функционалдық тобы бар қосылыс монофункционалды (метанол), бірнеше бірдей функционалды тобы бар қосылыстар- полифункционалды (глицерин), ал бірнеше әртүрлі функционалдық тобы бар қосылыстар гетерофункционалды (сүт қышқылы) деп аталады.
СН3-ОН –метанол СН2(ОН)СН(ОН)СН2(ОН)-глицерин СН3СН(ОН)СООН-сүт қышқылы
| Функционалдық топ | Кластың аталуы | Кластың жалпы формуласы | |
| формуласы | аталуы | ||
| Көмірсутектер | R-H | ||
| -F, -Cl, -Br, -I, -HaI | Галогендер | Галогентуындылар | R-HaI |
| -OH | Гидрокси | Спирттер Фенолдар | R-OH Ar-OH |
| -O- | Окси | Жай эфирлер | R-O-R’ |
| -SH | Меркапто | Тиолдар | R-SH |
| -NH2 | Амино | Аминдер(біріншілік) | R-NH2 |
| -NO2 | Нитро | Нитроқосылыстар | R-NO2 |
| -CO | Карбонил | Альдегидтер Кетондар | R-CH=O R-CO-R’ |
| -COOH | Карбоксил | Карбон қышқылдары | R-COOH |
| -SO3H | Сульфо | Сульфон қышқылдары | R-SO3H |
Көмірсутектер- молекулалары көміртек пен сутек атомдарынан тұратын органикалық қосылыстар. Алкандар радикалды қосылыстар орынбасу механизмі арқылы жүретін реакция түзеді, оны Sn таңбасымен белгіленеді.
Галогендеу. Алкандар ультракүлгін сәулелену немесе жоғарғы темературада әсер еткенде галогендермен әрекеттескенде, құрамындағы бірден-бірнешеге дейінгі сутек атомдары галогенмен алмасқан аралас гомогенді туындылар түзеді.
 СН3-СН3+Cl2 CH3CH2Cl+HCl
СН3-СН3+Cl2 CH3CH2Cl+HCl
Сатылары:1.Ынталандыру-галоген молекулаларының бос екі радикалға бөлінуі жүреді
 Cl:Cl 2Cl
Cl:Cl 2Cl
2. Тізбектердің өсуі
 Cl+CH3CH3 HCl+H3C-CH2
Cl+CH3CH3 HCl+H3C-CH2
 3. Тізбектердің үзілуі: Н3С-СН2+Cl2 H3C-CH2Cl+Cl
3. Тізбектердің үзілуі: Н3С-СН2+Cl2 H3C-CH2Cl+Cl
 Cl+ClCl:Cl
Cl+ClCl:Cl
Билет
1. Өзгерістер кезінде жүйе және оны қоршаған орта алғашқы қалпына келетін болса, өзгерістерді қайтымды термодинамикалық процесс дейді. Қайтымды процестерде темодинамикалық жүйе тепе-теңдік күйге ұмтылады, ол өзінің құрамын және қасиеттерін ұзақ мерзім өзгертпеуге тырысады. Табиғатта өз бетімен көбінесе қайтымсыз термодинамикалық процестер жүреді. Қайтымсыз процестер жүргенде жүйеде немес қор.ортада жойылмайтын өзгерістер п.б. М-лы: су оз бетімен тек төмен ағады, буланған сұйыұтық қайтадан ыдыстың үшіне жиналмайды, қартайған организм жасармайды. Қайтымсыз процестер термодинамиканың 2-ші заңына бағынады.
Өздігінен жүретін процесс -сыртқы факторлардың әсерінсіз жүретін термодинамикалық процесс.
Термодинамикалық қайтымсыз процесс – бұл жүйе бастапқы күйден соңғы күйге өтер аралықта үздіксіз тепе-теңдік күйде болатын процесс.
Қайтымсыз процесс – жүйені бастапқы күйіне сырттан энергия жұмсамай келтіруге болмайтын процесс.
Энтропия (S)- жүйенің ретсіздігінің сандық сандық мөлшерін көрсететін жүйе күйінің функциясы.
Больцман теңдеуі:
S=klnWi
Мұндағы, k- пропорционалдық коэф., Wi –термодинамикалық мүмкіндік, яғни жүйенің макрокүйіне сәйкес келетін микрокүйінің i саны.
Барлық жағынан мінсіз кристалдардың абсолюттік мәні нөлге тең болғанда энтропиясы да ең төмен шамаға, яғни нөлге тең болады. (S0=0)
Энтропияның шамасы артады
-температураны жоғарылатқанда
-Берілген қатар б-ша агрегаттық күйін өзгерткенде «кристалл-сұйық-газ»
Термодинаканың екінші бастамасының эквивалентті тұжырымдамалары:
-Жылу өздігінен суық денеден ыстық денеге ауыса алмайды. (Клаузиус-1850)
-Мүмкіндігі аз күйден мүмкіндігі көп күйге ауысатын жүйелер ғана өздігінен жүре алады.
-Оқшауланған жүйеде өз бетінше жүретін қайтымсыз процестер энтропия шамасының артуымен ғана жүре алады. (ΔS>0)
Математикалық өрнегі: ΔS≥Q/T
Гиббстің бос энергиясы (изобаралық-изотермиялық потенциал) (ΔG)-бұл жүйенің берілген процесте атқара алатын максималды пайдалы жұмысына абсолюттік мәні жағынан тең, таңбасы жағынан қарама-қарсы болатын термодинамикалық жүйе күйінің функциясы:
ΔG= -Amax
ΔG= ΔH-T ΔS
Процестің өздігінен жүру мүмкіндігінің шарттары:
- ΔG<0; ΔН<0; ΔS>0 (процесс өздігінен жүреді)
- ΔG>0; ΔН>0; ΔS<0 (процесс өздігінен жүрмейді)
- ΔG=0 (жүйе тепе-теңдік күйде болады).
2. Алкендер (Этилен көмірсутектері) Құрамында қанықпаған екі не үш байланысы бар қосылыстарды қанықпағандар деп атайды, өйткені мұндай қосылыстар құрамындағы жетіспейтін сутек атомдарының саны сәйкес екі не төрт орынбасарды қосып алады.
Жалпы фотмуласыCnH2n сәйкес және құрамында тек бір қос байланыс ғана бар қанықпаған қосылыстарды алкендер немесе олефиндер деп атайды.
Мұндай қосылыстарда σ-және π-байланыстары бірдей кездеседі, π-байланысының энергиясы 60ккал/моль, ал σ -80 ккал/моль. Демек, π-байланысы, σ-байланысынан әлсіздеу болғандықтан, ондағы реакцияға түсу үшін құбылыс кезіндегі шабуыл π жүйесіне бағытталған.
Алкен туындыларының электрофильді қосылу реакцияларының ерекшеліктері.
Марковников ережесін тек алкендердің өзіне ғана қолдануға болады, ал туындыларын қарастырсақ изомерлі интермедиаттардың тұрақтылығын бағалай білу қажет. М-лы: электроноакцепторлы тобы бар алкендерге НХ типті реагентті әрекеттестіретін болсақ, нуклеофиль әр кезде β-көміртегімен байланысқан болады.

Бұл құбылысты қарбкатионның α-көміртегі атомының аздаған оң зарядымекн тұрақсыздануымен түсіндіруге болады, ал ол оң заряд Ү тобына жататын көміртегі атомының зарядталуымен байланысты. М-лы: организмде α-,β-қанықпаған қышқылдардың гидротациясы β-оксикарбон қышқылдарының түзілуіне әкеледі.

 R-HC=CH-COOH+HOH R-HC-CH2-COOH
R-HC=CH-COOH+HOH R-HC-CH2-COOH
OH
Май қышқылдарының β-тотығуы кезінде жүретін реакцияның бірі.
Алкиндер (Ацетилен көмірсутектері)
Жалпы фор-сы СnH2n-2 сәйкес және молекуласында бір немесе бірнеше үш байланысы бар қанықпаған көмірсутектерді алкиндер деп атайды.
Алкиндердің тек бастаушы өкілі ацетилен НС≡СН, оның гомологтары жүйелік және рационлады номенклатура б-ша аталады:
Радикалдары: СН3-С≡СН метилацетилен, пропин;
СН2=СН-С≡CH винилацетилен бутин-1, ен-3;
НС≡С- этинил;
СН3-С≡С- пропин-1-ил
Морковников ережесі бойынша алкиндердің гидрогалогендеу реакциясы жүреді.

Арендер (Ароматты көмірсутектер)
Қабысқан жүйесі бар, тұйық тізбекті, ароматтылық қасиет көрсететін қосылыстарды арендер д.а.
Осы тектес басқа қосылыстардың бәрін де бензолдың туындысы ретінде қарастырады. Ароматтылық дегеніміз қосылу реакциясына түспей, тек электрофильді орынбасу реакциясына бейім қасиетті айтамыз.
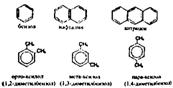
Бензол сақинасынаң санына сәйкес арендер моно және көпсақиналы болып б-ді. Көпсақиналы конденсацияланған және оқшауланған болып б-ді. Конд-ған түріне нафталин, антроцен, фенантрен, бензпирен жатса, оқшауланған түріне бифенил, дифенилметан жатады.
Билет
1. Реакция жылдамдығы
Хим р-я жылд-ғы – бұл бірлік көлемде (гомогендік р-лар үшін) н/се бірлік ауданда (гетерогендік р-лар үшін) бірлік уақыт ішінде әрек-тін мол-лар саны
Хим р-я жылд-ғы – бұл бірлік уақытта әрекеттесуші затт-ң н/се өнімнің концентр-ң өзгерісі
Хим р-ң орт жылд – берілген уақыт аралығындағы реакцияның жылд-ң орташаландырылған рөлі

Хим р-ң шынайы жылд – р-ң берілген уақыт шамасындағы (Δt>0) ж-ғы

Берілген N2+3H2=2NH3р-сы үшін екі түрлі түсінікте:
· Р-я жылд-ғын берілген зат б/ша анықтау

Өлшем бірлігі:
W=[молек*см-3*с-1] н/се W=[моль*м-1*с-1]
Хим р-ң кинетик негізгі пастулаты (масс-р әрекеттесуші заңы) тұрақты темп-да әрбір уақыт сәтінде, хим р-ң жылд-ғы, стехиометриялық конц-ң көбейтіндісінде тура пропорционал
aA+bB+cC=dD+eE
реак-сы үшін:

К реак-ң жылд-ң конст
Ca, Cb, Cc – әрекеттесуші затт-ң конст-сы
a, b, c – әрекетт зат стехиометриялық коэф-рі
Реак-ң жалпы кинет реті (n) бұл  типті теңдеудегі a, b, c дәреже көрсеткіштерінің қосындысы: n=a+b+c
типті теңдеудегі a, b, c дәреже көрсеткіштерінің қосындысы: n=a+b+c
Хим реак-ң әсер етуші фактор
· Әрек-ші зат-ң табиғаты
· Әрек-ші зат-ң концентрациясы
· Температура
· Катализатор-ң қатысы
Вант-Гофф ережесі температураны әрбір 10 градусқа көтергенде реак-я жылд 2-4 есе артады
Вант-Гофф ережесі-ң сәйкес теңдеуі (T2>T1) болғанда:



Мұндағы:
γ – р-ң темп-лық коэффициенті
t – р-ң жүру уақыты
Т – темп-ра
2. Спирттер – құрамында қаныққан көміртегі атомымен байланысқан бір н/се бірнеше гидроксил (ОН) тобы бар көмірсутек-ң туындылары
Жіктелуі:
1.Біратомды:
СН3-СН2-ОН – этанол
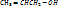 пропен-2-ол-1
пропен-2-ол-1
2. Екі не үш атомды
НОСН2СН2ОН – этандтол 1,2

 пропандиол- 1,2
пропандиол- 1,2
ОН

 пропантриол- 1,2,3
пропантриол- 1,2,3
ОН
Хим-қ қасиеті:
Спирттер құрамында бірнеше реак-қ орталықтар бар, мұндай қасиеттің себебі, бөлінбеген электрон жұбы бар оттегі атомына б-ты:
β α




 R-CH-CH2
R-CH-CH2 

HOH – қышқ орт-қ
Электрофильдік орталық. Нуклеофильдік n-негізді орт-қ
Нуклеофилдік орынбасу р-сы кезінде нуклеофилді субстратқа өзінің жұп электронның бірін, субстратпен байл түзеді

Спирттерде СН қышқ орт-ға бейтарап элиминдену реак-сы тән ( . Бұл реак-я күшті қышқ орт-да жоғары темп-да өтеді
. Бұл реак-я күшті қышқ орт-да жоғары темп-да өтеді
H HHH
 |  |  |  |





H HHH
Алкилдеу бұл реакция спирттер әлсіз нуклеофилдік қасиет көрсетіп жай эфирлер түзеді. Алкилдеуші агенттер ретінде галоген туындылар, диалкилсульфаттар ж/е алкилсульфонаттар қолд-ды.Мыс: Вильямсон синтезі: Алдоксид галоген туындылармен әрек-де жай эфир түзіледі
CH3CH2ONa+CH3(CH2)3B  3CH2O(CH2)3CH3
3CH2O(CH2)3CH3
натрий бутил бутилэтил эфирі
этоксиді бромиді
Билет
Ерітінділер – еріткіштен еріген заттан және олардың өзара әрекеттесуінен түзілген біртекті жүйе. Ерітіндідегі бөлшектердің мөлшеріне байланысты оларды 3 топқа бөледі:
1) Шын ерітінділер, бөлшектерінің мөлшері 1ммк-нан кіші
2) Коллоидтық ерітінділер, бөлш-ң мөлшері 1-100 ммк арасында
3) Жүзгін ерітінділер. Оның бөлшектері микроскоппен кейде, жай көзбен де көрінеді. Бөлш-ң мөлш-і 100ммк-нан үлкен.
Ерітінділердің еріген зат-ң мөлшері б/ша жіктелуі:
- қанықпаған
- қаныққан
- аса қаныққан
Қанықпаған ерітінді – концентрациясы қаныққан ерітіндінің конц-нан жоғары болатын, берілген жағдайлар өзгеріссіз болғанда еріген заттың қ/ша мөлшерін еріте алатын ерітінді
Қаныққан ерітінді – еритін зат-і басымен динамикалық тепе-теңдік күйде болатын, заттың еру жылд-мен кристалдану жылд-ғы тең болатын ерітінді. Яғни, қаныққан ерітінді д/з берілген жағдайлар өзгеріссіз болғанда затты одан әрі еріте алмайтын ерітінді.
Аса қаныққан ерітінді – конц-сы қаныққан ерітн-ң конц-сынан жоғары болатын, тер-қ тұрақсыз ерітінді,
Кәдімгі не шын ерітінділерді, кейде иондық не молекулалық ерітінді д.а. Иондық ерітінділер – NaCl, Na2SO4, KCl. Молекулалық ерітінділер – глюкоза, мочевина, глицерин ерітінділер.
Заттың агрегаттық күйлеріне байланысты ерітінділер былай бөлінеді:
1. Сұйық ерітінділер
2. Қатты ерітінділер
3. Газды қоспалар
Ерігіштік деп берілген заттың қандай да бір еріткіште еру қабілетін айтады.
У.Генри мына заңды ашты: Тұрақты темп-да газдың еріткіштігі (Pc) берілген сұйықтың көлемінде оның ерітінді үстіндегі парциалды қысымына тәуелді: Pc=K*Pr
Сұйылтылған ерітінділер үшін Р20 орнына тәуелділік коэффициентін пайдаланады:
P=K*N2
Бұл теңдеу Генри заңы деген атпен белгілі. Ал тәуелділік коэффициенті Генри тұрақтысы деп аталады. Ол еріткіш және еріген зат табиғаттарына, сонымен қатар, темп-ға тәуелді.
Газ-ң судағы ерігіштігі онда электролит еріген кезде өте төмендейді. И.М. Сеченов газ ерігіштігі мен электролит концентрациясы арасындағы байланысты анықтайды:
lgN0/N=kc мұнда, N0 және N газ-ң таза судағы және тұз конц-сы C ерітіндідегі мольдік үлестері, к-газ, электролит табиғаттарына не температураға тәуелді тәжірибелік тұрақты.
Ерітінділердің конц-сын көрсетудің бірнеше жолы бар:
1. Мольдікпен өлшенетін ерітніділер. Ерітіндінің 1 литрінде неше моль еріген зат бар екендігін көрсетеді де, М әрпімен белгіленеді. CM=n(x)/vерт=m(x)/M(x)+vерт;моль/л
2. Моляльдікпен өлшенетін ерітінділер. Еріткіш-ң 1000 г еріген зат-ң неше молі бар екендігін көрсетеді; Cm=n(x)/mерітк
3. Нормальдік ерітінділер. Ерітіндінің 1 литріне неше г – эквивалент еріген зат бар екендігін көрсетеді.
Сн – зат эквив-і мөлш-ң nэ ерітнді көлемі-ң қатынасына тең шама
Сн=nэ(x)/vерт=m(x)/fэкв*M(x)*vерт; г экв/л
СМ және Сн арасындағы өзара байланысты См=fэкв*Сн
4. Массалық үлес, w(x) – еріген зат массасының m(x) ерітіндінің жалпы массасының қатынасына тең шама, оны процентпен не бірліктің үлесіне тең шамалармен көрсетеміз:
W(x)=m(x)/mерт*100%
5. Ерітінді титрі – зат массасы-ң ерітнді көлеміне қатынасы, яғни 1мл ерітіндідегі еріген зат-ң массасын береді: T=m(x)/vерт; T=CH*Э/1000г/мл
Бейэлектролиттер деп ерітіндісі не балқымасы электр тогын өткізбейтін заттарды айтамыз Мыс: эфир, спирт
Коллигативті деп еріген зат-ң табиғатына тәуелсіз, тек оның мольдік концентрациясына байланысты қасиеттерді айтады.
Сұйылтылған ерітінділер үшін мұндай қасиеттерге ерітінді үстіндегі қаныққан бу қысымының төмендеуі, қайнау темпер-ң жоғарылауы және қату темп-ң төмендеуі, осмос қысымы жатады. Коллигативті қасиеттерді зерттеу арқылы еріген заттың мольдік массасын, оның диссоциациялану не ассоциациялану дәрежелерін анықтауға болады.
Диффузия – молек-ң жылулық хаосты қозғалысы нәтижесінде затт-ң конц-сы жоғары бөліктен конц-сы төмен бөлігіне өздігінен өту үрдісі.
Еріткіш молек-ң жартылай өткізгіш өткел арқылы жұйедегі еріген зат-ң конц-сы төмен бөләктен жоғары бөлігіне өздігінен өту процесін осмос д.а. Осмосты тоқтату үшін ерітіндіге түсірілген қысымның шамасын осмос қысымы дейміз.
Вант-Гофф 1887ж мына заңды ашты: Ерітінд-ң осмос қысымы еріген зат идеал газ күйінде болып, сол темп-да ерітнід-ң көлеміндей көлем алып тұрғандағы туғызатын қысымына тең.
P=CRT мұнда Р-Осмос қысымы, С-концнтр-я, R-молдік газ тұрақтысы, Т-абсол темп
Рауль заңы ерітінді ұстіндегі ерітк-ң бу қысымының салыст төмендеуі. Еріген зат-ң мольдік үлесіне тең, яғни еріген зат-ң моль санын еріген зат пен еріткіштің мол санд-ң қосындысына бөлгенге тең.
 Мұндағы:
Мұндағы:  -таза ерітк-ң қаныққан бу қысымы. N, n берілген зат пен еріткіштің моль сандары.
-таза ерітк-ң қаныққан бу қысымы. N, n берілген зат пен еріткіштің моль сандары.
Ерітінд-ң қатуы мен қайнауын зерттеп, Рауль мына заңд-ды ашты.
Ерітінд-ң қайнау темп-ң жоғарылауы мен қату темп-ң төмендеуі еріт-ң молялдылығына тура тәуелді.
Δtқату=Km Δtқайнау=Em
E ж/е K – эбулиоскопия-ң (қайнау) және криоскопия-ң (қату) тұрақтылары олардың мәндері еріткші табиғатына байл-ты затт-ң молялдық конц-сы.
Гемолиз – сыртқы ортаға гемоглобин шығып, еріт-ң қызыл түске боялуы.
2. Аммиак молекуласындағы бір не бьірнеше сутек атомдары көмірсутек радикалына алмасудан түзілген органик қосылыстар аминдер д.а. Аминдер құрам-ғы көмірсут радикал-ң санына б/сты 1-лік, 2-лік, 3-лік аминдер ж/е 4-лік аммоний тқздары болып бөлінеді.
Физ. Қасиеті. Төменгі аминдер аммиакка ұқсас иісі бар. Төмен темпер-да қайнайтын газ н/е сұйық зат. Төменгі алифатты аминдер суда жақсы ериді.
Хим қасиеті. Аминдер қышқ-мен әрекеттескенде тұз түзеді де күшті негіз-ң әсерінен қайтадан бос аминдер түзіледі. Аминдер аммиак сияқты негіздік қасиет көрсетеді, ол құрамындағы азоттың жұп электроны болуына байл/ты, сондықтан қышқылдармен әрекеттесіп, аммоний түздарына айналады. Көптеген аминдер тобына жататын дәрілік препараттар минералды не орг қышқ-ң тұздары түрінде болады.
Аммиакты және аминдерді тотықсыздырып алкилдеу:
С6H5-CHO NH3, H2, Ni/90атмC6H5-CH2NH2
Бензальдегид бензиламин
Аминдер негіздік қасиет көрсетеді, ол қышқ-мен әрекеттесіп аммоний тұздарына айналады.
Бір көміртек радикалымен байл/қан азо- тобы бар қосылыстарды диазоқосылыстар деп атайды.

4-нитробензолдиазоний хлорид
Құрамында екі көмірсутек радикалымен байл-қан азо- тобы бар қосылыстарды азоқосылыстар д.а.

4-гидрокси-2-метилазобензол
Билет
1. Электролиттер-еріткенде н/се балқытқанда иондарға ыдырайтын және өз бойынан электр тогын өткізетін заттар.
Оствольттың сұйылту заңы: әлсіз электролиттердің дисс-ну дәрежесі еріген заттың концентрациясының квадрат түбіріне қарама-қарсы тәуелді, ал сұйылту дәрежесіне тура тәуелді.
Электролиттік дисс-я- заттың молкулаларының еріткіштің полярлы молекулаларымен электростатикалық әрекеттесуі барысында заттың иондарға ыдырау процесі.
Электролиттік дисс-ну константасы- К-әлсіз электролиттің ерітіндісіндегі иондардың концентрацияларының көбейтіндісінің дисс-баған молекулаларының концентрациясына қатынасы. Дисс-ну константасыэлектролиттіңионғаыдыраушылыққабілетінкөрсетеді.
НА Н++А- -реакциясыүшін
К=(⦋Н^+⦌∙⦋А^-⦌)/(⦋НА⦌)
Оствальдтыңсұйылтузаңы
К=〖Са〗^2/(1-а); егер а˂˂1, онда К=Ca2,
К-қышқылдың (негіздің) иондануконстантасы
а-қыш-ң (негіздің) дисс-ну дәрежесі
С-қыш-ң (негіздің) концентрациясы
Күштіэлектролиттерерітіндідетолықиондарғадисс-нады. ЕҒрітіндінің кон-сынеғұрлымжоғарыболса, әрбір ион өзінеқарама-қарсыиондардытартыпиондық атмосфера түзеді.
Активконцентрациясы – ион-ң шартты кон-сы, күштіэлек-ң нағыз кон-на тура пропорционал.
НClH+ +Cl-
K=(〖αH〗^(+) 〖∙αCl〗^-)/αHCl
Қышқылдар мен негіздердібұл теория б-шапротолиттердеп, ал олардыңбірімен-біріәрекеттесуінпротолиттік тепе-теңдікд.а.
Протолиттік, яғниБренстед-Лауритеор.сы б-ша, қыш-дар дегенімізсутекионын (Н+) беретін молекула, не ион (донор).
2.Альдегилтар мен кетондардепқұрамындакарбонилтобы бар көміртектуындыларынайтады.
Оксотоп-
Альдегидтің жалпыфотмуласы:
Кетондардың жалпыформуласы:
Карбонилтобыныңкөміртекжәне оттек атомдарыSp2-гибридтенген күйіндеболады. Сондықтанкарбонилтобыжәнеоныменбайланысқанатомдарбіржазықтықтыңбойындажатады.
π-байланыс рz-орбитальдардыңбүркесуіарқылытүзіледі. Оттек атомыныңбөлінбегенжұпэлектрондарыSp2-орбитальда орналасады, яғни рz-орбитальдарынатікбағыттажәнеπ-байланыспенқосарлануғатүспейді. Карбонилотобыныңπ-байланысыөзарабайланысқанатомдардың электртерістіктерініңәртүрлігісалдарынанполярланған.
Көміртек атомы осы себептенэлектрофильдіжәненуклнофильдіреагенттерменәрекеттеседі.Сондықтаноксоқосылыстарға, C=Cбайланысыәсеріненэлектрофильдіқосылуреакциясынатүсетіналкендергеқарағанда, нуклеофильдіқосылуреакцияларытән.
Альдегидтер мен кетондардыңэлектрондыққұрылысы:
Альдегидтер мен кетондардыңхимиялыққасиеттері:
Спиртпенәрекеттескендеоларжартылайацетальжәнеацетальтүзеді
Жартылайацеталь мен ацетальдыңтүзілупроцестеріқайтымды.Егер су мөлшеріартыұболса реакция солға, яғни альдегид пен спирттіңтүзілуібағытынақарайығысады. Алегерспирттіңартықмөлшеріпайдаболса, онда реакция оңғаацетальдыңтүзілубағытынақарайығысады.
Ацетальдауреакциясыныңмаңызы. Ағзадан «бөгде» заттарацетальдартүріндебөлініпшығады. Мысалы, бауырдағыглюкуронқышқылы(циклдіжартылайацеталь) ағзада, дәрілікзаттарды, амин қышқылыныңтасымалдануындапайдаболатынкөптегенгтдроксилтобы бар заттарменацетальдартүзеді.
Билет
1) Буферлік жүйелер дегеніміз сыртан әсері болғанда өзінің қандайда бір параметірінің шамасын өзгертпей тұрақты қалпында сақтайтын жүйелер. Ол адамның қанның жүйесінде сутек көрсеткішті реттеп отыратын арнаулы жүйелері бар, соның бірі буферлік жүйе. Буф жүй негізі қасиетінің бірі орта қышқылдын сілтінің қосылуына н/е Сүйылуына қарамастан сутектік көрсеткішті турақты етіп отыруб, бұл жүйенің құрамынна байланысты бірнеше түрге бөлінеді. 1.Әлсіз ыдырайтын қышқыл осы қышқылдын күшті негізбен түзетін тұзы (H CO Na HCO) Әлсіз негіз осы негіздің күшті қышқылмен түзетін тұзы (NH OH NH HCL) 3.Амфотерлі (HN CH COO) Электролиттер ерткенде н/е балқытқанда иондарға ыдырайтын ж/е өз бойынан электір тоғын өткізетін заттар. Электорлиттін диссоциация заттын молекулаларының еркіштің полярлы молекулаларымен электростатикалық әрекеттесуі. Протолиттік буферлік жүйе сұйылтқанда Аздаған мөлшерде күшті қышқыл қосқанда РНтің мәнін тұрақты сақтайтын қалпында сақтайтын жүйе Протолит буферлік жүйелер жіктеледі. Қышқылдың буферлер ацетаты СН СООН СН СОО Na Негіздік сілтілік амалшақты NH OH NH CL Буферлік ертіндінің әсер ету механизмі; Күшті қышқыл қосқанда HCL тұзбен CH COONa әрекеттеседі; нәтежесінде күшті қышқылға эквиваленті мөлшеріде әлсіз қышқыл түзіледі сірке қышқылының концентрациясы көбейеді ал диссоциациялану дірежесі төмендейді сондықтан да сутек иондарының концентрацясы ж/е ертіндінің рН ң өзгеріссіз қалады.
Гендерсон Гассельбах теңдеуі Қышқылдың буферлер үшін рН рКа pH=pKa-Lg Ca Va C C V
Сілтілік буферлер үшін PH=14-pKb-Lg C V.. C V
7-билет.
1 Химиялық байланыс- атомдарды не молекулаларды бір-бірімен жаңа тұрақты құрылыммен байланыстыратын куштердің жиынтығы.
Химиялық байланыс түрлері:коваленттік (полюсті,полюссіз), иондық, сутектік, координациялық байланыстар.
Ковалентті байланыс-атомдардың электрондардан ортақ электрон жұбын түзу арқылы байланысуы.
Ковалентті полюсті-электртерістілігі әр түрлі атомдар арасындағы байланыс.
Ковалентті полюссіз-электртерістігі бірдей атомдар арасындағы байланыс.
Иондық байланыс-қарама-қарсы зарядталған ионның арасындағы байланыс.
Сутектік байланыс- сутек атомы мен электртерістілігі жоғары басқа бір атомның арасындағы коваленттік байланыс.турлері:молекула ішілік,молекула аралық,
Координациялық байланыс-бір атомның қос электронды орбиталі екінші атомның бос орбиталімен жұптасқанда түзілетін байланыс.
Валенттік байланыс әдісі:
1)екіатомның сыртқы электрон қабатындағы жалқы электрондары жұптасып осы 2 атомғада ортақ,екі атомның да ядроларын айналып журетін электрон жұбын түзу арқылы химиялық байланыс пайда болады.
2)электрон жұбын түзуге спиндары бар қарама-қарсы болатын жалқы электрондар ғана қатыса алады.
3)бір атомды екінщі атоммен байланыстыратын электрон жұбының саны сол атомның валенттілігіне сәйкес келеді.
Молекулалық орбиталдар әдісі:
1)молекула-бір тұтас бүтін жүйе және ондағы күллі электрондар сол молекулаға ортақ.
2)молекуладағы электрон атомындағыдай бір ядроның өрісінде емес, молекула құрамындағы барлық ядролар өрісінде болады.
3)молекуладағы әр электроға молекулалық орбиталь сәйкес келеді.
4)молекулалық орбитальарға электрондардың орналасуы орбитальдар энергиясының өсуі реті бойынша, Паули принципі мен Гунд ережесіне сай өтеді.
Атомдық орбитальдардың гибридтенуі-атомның пішіні және энергиялары әртүрлі орбитальдарының өзара араласып, бір пішіндес және энергиялары бірдей жаңа орбитальдарға айналуы. Түрлері:
Sp-s және Р орбитальдарының қатысуымен түзілген орбитальдарды гибридтену д.а. (ацетилен)
〖sp〗^2гибридтену
sp^3гибридтену
2) Аминоспирттер. Маңызды өкілдері:
Коламин NH2CH2CH2OH және холин (CH3)3≡N-CH2-CH2-OH биологиялық мембр-ң құрамына кіретін кефадин мен лецитиннің құрам бөліктері.
Дофамин  норадреналин
норадреналин  және адреналин
және адреналин  бүйрек ұст безі-ң ми заты-ң гормоны. Алрен-ң жүрек жұмысын реттейді, көмірсулар-ң алмасуына қатысады.
бүйрек ұст безі-ң ми заты-ң гормоны. Алрен-ң жүрек жұмысын реттейді, көмірсулар-ң алмасуына қатысады.
Серотонин 
АМҚ пептид пен белок-ң мономері. Құрамы амин тобы NH2-, карбоксил тобы -COOH. АМҚ саны 70, көп кездесетіні 20. АМҚ суда жақсы ерид түссіз кристалл зат, тәтті. Жануарларда әдетте альфа-АМҚ болады.
H2N-CH-COOH
R
Лактам(бета-гамма-дельта) 
Лактон күрделі эфир CH2n-COO-
Элиминирлеу 
8-билет. Валентті байланыс көзқарасымен комплексті қосылыстардың сипаттамасы.Валенттік байланыс бойынша орталық атоммен лиганд донорлы-акцепторлы әдіс бойынша байланысады. Әдетте орталық атом байланыс түзуге бос орбитальдарын,лиганд пайдаланылмаған электрон жұбын жұмсайды. Демек орталық атом –акцептор, лиганд-донор молекула немесе ион лиганд рөлін атқару үшін оның құрамындағы атомның пайдаланылмаған электрон жұбы болуы керек.
Комплексті қосылыстар- қатты күйіндеде, еріген күйінде де өз құрамын тұтас сақтайтын күрделі иондардан немесе молекулалардан тұратын қосылыстар.
Тірі ағзалардағы комплексті қосылыстар:
· Гемоглабиннің, циктохромның негізін құрайтын –порфириннің темір катионымен түзетін комплексі.
· Хлорофилдің негізін құрайтын-порфириннің магнии катионымен түзетін комплексі.
· Цитохромоксидазадалардың негізгі-порфириннің темір және мыс катиондарымен түзетін комплексі.
Комплексті қосылыстарды ғылыми тұрғыдан- Альфред Бернер зерттеген, бұл жайындағы жұмысы кординациялық теория д.а. бұл теория бойынша.комплексті қосылыстарда, оны түзуші металл ионынан тұратын координайиялық сфера болады да, оның маңайында теріс зарядталған аниондар немесе электр бейтарап молекулалар лигандалар орналасады. Металл ионы мен осы аталған лигандалар комплекс қосылыстарының ішкі сферасын түзеді.
 2
2  2++2OH-
2++2OH-
Адам ағзасы үшін ас қажетті қосылыс ішкі комплексті қосылыс- гемоглабин екі атайды оттекті өкпеден ұлпаларға жеткізуде биологиялық маңызы зор.гемоглабиннің простетикалық тобы тотығу-тотықсыздану реакцияларын катализдейтін пероксидаза ферменттерінің және метоболизм процессі кезінде түзілетін сутектің асқын тотығының ыдырауын жылдамдататын каталоза ферменттің құрамды бөлігі болып табылады.
ГЕМОГЛАБИН өзінің құрамындағыпростетикалық топтар гемдерден және глобиннен тұрады.
Оның комплекс түзуші рөлін темір металы атқарса ол лигандар ретінде пиррол сақиналары б-ы.
Өсімдік тіршілігінде маңыздысы хлорофтлл-пигменттер, олардың көмегңмен өсімдіктерде және балдырларда фотосинтезпроцесі жүзеге асады Хлорофилдер- комплекстүзуші магний ионы және онымен 4 байланысқан органикалық бөліктен тұратын ішкі комплексті қосылыстар.
Комплекс ионның заряды комплекс түзуші мен лигандалар зарядтарының алгебралық қосындысына тең.
Темір- оттекті өкпеден ұлпаларғатасымалдаушы болып табылатын гемоглабиннің белсенді орталығы.
Кобальт- қан ұю процесінде маңызды рөл атқаратын В12 витаминінің құрамдас бөлігі;қалқанша без қызметінің ширату көмірсулар алмасуын реттеу; кейбір ферменттердің синтезіне қатысу.
НИКЕЛЬ-а ғзадағы гармониялық реттеуге қатысу,қан ұю процесіне қатысу.
ХРОМ- көмірсулардың алмасу процесіне қатысу;ақуыздардың алмасу процесіне қатысу.
Марганец -көптеген ферменттерді белсеніру; антиденелерді өндіруді жеделдету;қан ұю процесін жақсарту;атеросклероз дамуын тежеу; С витаминінің синтезіне қатысу.
2)α-амин қ-дары -мол-ла құрамында амин ж/е карбоксил тобы бар гетерофункционалды қосылыстар.Ең маңыздысы-α-амин қышқылдары.Оның жалпы формуласы
 R-СН-СООН
R-СН-СООН
NН2
α-амин қ-ры-суда жақсы еритін кристалдық заттар.Олардың көбіне тәтті дәмі бар.Тірі ағза үшін α-амин қ-ның негізгі көзі ретінде тағамдық ақсылдар б.е.
α-амин қ-ры:алифатты,ароматты ж/е гетероциклді б.б.Мол-дағы карбоксил ж/е амин топтарының санын ескерсек,негіздік бейтарап(моноаминокарбон),(диаминокарбон)ж/е
қышқылдық(моноаминдикарбон)

α-амин қ-ның құрылым тәртібі,яғни бір көміртек атомының өзінде екі әр түрлі функциялы топтардың (NН2ж/е СООН),радикалдық (R)ж/е сутек атомының (Н)болуы α-көміртек атомының хиральдылығын тұғызады.
α – амин қ-ның көміртек атомының өзінде 2 түрлі функциялы топтардың(NН2,СООН),радикалдардың RNH2 ж/е сутек атомының болуы (Н) α-көміртек атомының хиральдылығын туғызады(глицин бағынбайды)

X имиялық қасиеті:
α-амин қышқылдары амфотерлік қасиет көрсетеді, себебі оның құрамында қышқылдық қасиет беретін карбокси тобы және сілтілік қасиет көрсететін амин тобы бар.

Биологиялық маңызды химиялық р-лары:
1)трансаминделу-α-амин қ-лы αоксоқышқыл биосинтездеудің негізгі жолы.
Билет
Вернадский аныктамасы б/ша ағзада жинақталып әртүрлі биологиялық қызмет атқаратын элементтерді биогенді д.а.
Менделеевтің периодты жүйесіндегі элементт-ң кванттық-механикалық түсініктемесі арқылы элементтерді жіктеу электрондық құрылымына б/ты жүзеге асады. Ол әртүрлі электрондық орбиталь-ң (s, p, d, f) толуына негізделген. Элементтерді s, p, d, f элементтер деп бөледі.
Менделеев-ң периодтық жүйесінің ІА ж/е ПА негізгі топшасында орналасқан. Олардың сыртқы электрон қабатында бір н/е екі электроны бар, олар оң иондарға айналады. S1-элементтер әлсіз тотықсыздандырғыштарға жатады.
Р-элементтерге Менд-ң периодт жүйесі-ң IIIA-VIIIA топтарына орн-қан элементтер жатады. Оларға Al, Pb, As жатады. Р-элементтердің гидроксидтері амфотерлік қасиет танытады. Р-элем-ң катиондары әртүрлі тотығу дәрежесін көрсетеді. Радиусының кішіреюі мен ядро зарядының үлкеюіне б/ты күшті поляризацияланатынға жатады. Элем-і тотығу дәреж төмендеген сайын, тұз-ң гидролиз дәреж-сі өседі. Р-элем ауыспалы валенттілік көрсете отырып тотығу-тотықсызд реак-на оңай түсед, әр түрлі қышқ түзеді, элем-ң тотығу дәреж өскен сайын қышқ-ң күші артады. Р-элем-ң көбісі оттекті қышқ
ІА тобы-ң S элем. Биосф-да сутек бос күйде кездеспейді. Ол су газ, орг зат-ң құрамында болады. Ағзада 2 түрлі құрамды электролит болады: ішкіжасушалық, онда калий катиондары және жасуша сыртындағы онда натрий иондары толады.
Литий-микроэлемент.
ІА тобы-ң S элем-і медицинада дәрілер жасауда қолд-ды.
ІІА тобы-ң S элем-і. Берилий-биол рөлі анықталмаған. Мөлшері аз болса бериллоз ауруы болады.
Магний. Адамда 40г болады, көбі сүйек ұлпасында.
Кальций сүйек ұлп-ң басты элем-і. Жүрек тамыры мен жұйке жұй-ң жүмысында маңызы зор. Кальций тапшылығы гипертоникалық кризиске, жүктілік токсикозына шалдықтыруы мүмкін, сүйек мықтылығы төмендейді.
Барий рентген сәулесін жақсы жұтады, сондықтан асқазан мен ішекті зерттеуде қолд-ды.
Стронций аз болса стронцитті оахит ауруы болады.
ІІІА тобының р-элементтері.
Бор- Н3ВО3 бор қышқылы антисептик ретінде әр түрлі майлар құрамында болады. Na2B4O7+10H2O натрий тетрабораты, антисептик.
Алюминий. Мед-та KAl(SO4)2*12H2O жұмсартатын, күйдіретін, қан тоқтататын әсері бар.
Al2(OH)3 алюминий гидроксиді асқазан сөлінің қышқылдығын төмендетеді.
IVA тобы-ң р-элементтері
Көміртек-орг қосылыс түзеді. Көміртек оксиді адамға зиянды. Ол қанға өтіп карбоксигемоглобин түзеді. Пеш газымен уланғана гемоглобин оттегімен байланысы болмай өлімге әкеледі. Медта активтелген көмір, ауыр метал тұзымен, алколоидтармен уланғанда көмектеседі. NaHCO3 натрий гидрокарбонаты асөазан сөлінің қышқ-ғын төмендетеді.
Кремний-микроэл. Тері, көз, Сіңірде кездеседі
Қорғасын-медта антисептик ретінде қолданылады.
2. Моносахаридтер гетерофункц-ды қосылыстар – полигидроксиальдегидтер не полигидроксикетондар. Құрамында альдегид болса альдоза, кетон болса кетозалар д.а. Суда жақсы, суда нашар, эфирде ерімейді.

Моносах- триоза, тетроза, пентоза, гексозаға бөлінеді.
Қарапайым триоза-глицерин альдегиді.

Карбонил тобымен көршілес орналасқан ассиметриялық көміртегінің орналасуында айырмашылығы бар альдозаларды эпимерлер д.а. Мыс: D-глюкоза D-манноза
Моносах-ге тән таутомерия түрін – цикло-оксотаутомерия (сақиналы-тізбекті) д.а.

Моносахаридтер-ң циклдік формулалары (Хеуорс формуласы) алты мүшелі гетероцикл – пиран мен бес мүшелі – фуран қаңқалары қрнектеледі.


альфа-Глюкоза
Хим қасиеті:
1 Гидроксил тобы бар қосылыспен әрекеттесіп циклді ацеталь – гликозид түзеді.
2 Сілтілік ортада монос-ң спирт тобы мен алкилгалогенид әрекеттескенде гликозид түзіледі, ал ол қышқылдық ортада гидролизденіп жай эфир түзеді.
3 Ангидриттермен ацилденіп күрделі эфир түзеді
4 тотықсызданып көп атомды спирттер – альдиттер түзеді


№10 БИЛЕТ
1) 2 қарама қарсы күштің бір бірімен әрекеттесуі нәтижесінде металдың суда еруі текқана металм мен ерітіндінің түйіскен жерінде болатын процесс сияқты сипат алады.Олардың түйіскен жерінде металдың ерігіштігінің нашарлығына қарамастан концентрациясы,едәуір жоғары болуы мүмкін.Гидраттанған катиондар металл торындағы электрон бұлтымен электростатикалық тартылыс күші арқылы берік байланыста болады.Сонымен метал мен су түйіскен жерде металдың бетін жабатын,қос электр қабаты п.б.Осы қабаттар арасындағы потенциалдар айырымын металдық,электродтық потенциал деп аталады.
Нернст теңдеуі
Металл ионының концентрациясы (C) тепе-теңдік күйдегі концентрацияға қарағанда көп болса онда ерітіндідегі металл иондары металл бетіне барып қайта қонады.
Метал пластинкасының беті оң зарядталады да оның ерітіндімен түйіскен жері теріс теріс зарядталады.Кез келген электрондық электрод потенциялын есептеу үшін Нернст теңдеуі қолданылады.
Тотығу тотықсыздану электродтық потенциалдар бұл фаза аралық шекарадан электрондардың өту есебінен жүретін тотығу-тотықсыздану реакцияларының нәтижесінде,электроөткізгіш құрамында қосарланған тотыққан тотықсызданған жұбы бар ерітінді шекарасында п.б. потенциал секірмесі.
Диффузиялық потенциал-(φд,β) бұл ерітінді-ерітінді фазалар бөліну бетінде иондардың бөліну шекарасы арқылы әр түрлі жылдамдықпен бағытталып өтуі нәтижесінде п.б. потенциал секірмесі.
Мембраналық потенциал -(φм,β) бұл мембрана ерітінді фазаларының бөліну бетінде мембрананың таңбалы өткізгіштігінің салдарынан п.б. потенциал секірмесі.
2) Олиго ж/е полисахоридтер –бағалы тағамдық заттар болып келеді жасушалар энергия алатын қосылыстар ретінде белгілі ж/е олар ыдыраған кезде жай моносахаридтерге ыдырайтын заттар.Жасуша мембранасының құрамындағы электролиттерде кездесетін олигосахаридтер-«өзіндік ерекше локаторлар» болып келеді,өйткені солар арқылы клеткалар бірін бірі «танып» біледі.Полисахоридтерде-жасуша ішінде нейтралды полисахоридтер резервтік қор ретінде кездеседі.Жасушадан тыс әдетте қышқыл полисахаридтер жиі ұшырасады.
Дисахаридтер (олигосахаридтер)〖С 〗_12 H _22 O _11
2-ге бөлінеді: 1)Тотықсыздандыратын2)Тотықсыздандырмайтын
2) Дисахаридтердің жалпы формуласы  Дисахаридтер тотықсыздандыратын және тотықсыздандырмайтын болып екіге бөлінеді
Дисахаридтер тотықсыздандыратын және тотықсыздандырмайтын болып екіге бөлінеді
Тотықсыздандыратын дисохаридтерге мальтоза, лактоза және цкллибиоза жатады.
Мальтоза ᵦ амилаза ферментінің әсерінен тағамның негізгі компаненті крахмал ыдырағанда түзілетін өнім.Мальтоза қышқылдық ортада гидрролизденгенде екі молекула глюкоза тізіледі.

|
Мальтоза моносохаридтер сияқты тотығып,мальтобион қыщқылын түзеді.

|
Целлобиоза Полисохарид целлюлозаны гидролиздегенде түзілетін өнім.
Целлобиоза мальтоза сияқты (1-4) гликозидтік байланыспен байланысқан екі D- глюкопиранозойд қалдықтарынан тұрады.

|
Дисахаридтердің гидролизі қышқыл ортада моносохаридтер түзу арқылы жүреді
Малбтоза  D – глюкоза
D – глюкоза  D– глюкоза
D– глюкоза
Целлобиоза  D – глюкоза
D – глюкоза  D– глюкоза
D– глюкоза
Лактоза  D – глюкоза
D – глюкоза  D– глюкоза
D– глюкоза
|
|
 2018-01-21
2018-01-21 1635
1635







