Все э/х цепи подразделяются по 2 признакам:
По характеру суммарного процесса, лежащего в основе действия э/х элемента:
а) химические б) концентрационные
По наличию или отсутствию диффузионных или жидкостных потенциалов (по наличию границ растворов)
а) цепи без переноса (без жидкостной границы, диф. потенциал отсутствует)
б) цепи с переносом (с жидкостной границей)
Химические цепи – состоят из 2-х электродов, на которых протекают различные по природе э/х реакции.
Химические цепи без переноса.
а) содержат один электролит, но один электрод обратим по катиону, а другой по аниону:газовый – газовый 1. (-) Pt, H2 êHCl êCl2, Pt (+)êводородный хлорный
2. I рода – газовый(-) Pt êZn êZnCl2 êCl2 Pt (+)
3. газовый II рода(-) Pt, H2 êHCl êHg2Cl2, Hg êPt (+)
4. амальгамные II рода(-) Ag êPt êK(Hg) êKCl êAgCl, Ag (+)
5. I рода – II родартутно-кадмиевый
б) э/х цепь содержит один электролит, но оба электрода обратимы по аниону:
II рода – газовый каломельный хлорный
(-) Pt, Hg, Hg2Cl2 êKCl êCl2 (p=1 атм., Pt (+)
ЭДСцепи = Е = Е0 = const не зависит от концентрации электролита KCl.
II Химические цепи с переносом.
Химические цепи с переносом содержат 2 электролита, которые контактируют между собой через диафрагму, мембрану или солевой мост.
(-) Pt êNi êNiSO4 êêKCl êHg2Cl2, Hg êPt (+)илиI рода – II рода (-) Pt êСd êCdSO4 êêFe3+, Fe2+ êPt (+)I рода – Red-Ox (редокс элек.)(-) Pt êSn2+, Sn4+ êêFe3+, Fe2+ êPt (+)Red-Ox – Red-Ox (-) Cu êZn êZnSO4êêCuSO4 êCu (+)I рода – I рода(элемент Якоби-Даниэля)
I Концентрационные цепи без переноса – содержат один электролит.
Амальгамные цепи – состоят из двух одинаковых по своей природе амальгамных электродов с различными активностями металла в амальгамах (а1 и а2):
(-) М1 (Hg) êMA êM2 (Hg) (+)электролита1 > а2
Электродные реакции: (+) Мn+ + ne ® M(Hg) – восстановление(-) M(Hg) – ne ® Мn+ - окисление
Электродный потенциал каждого электрода: 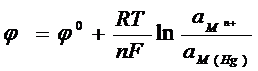
Суммарный процесс в Г.Э. заключается в переходе металла из более концентрированной амальгамы в менее концентрированную и не является электрохимической реакцией.
M(Hg) ® M(Hg)
a1 a2
ЭДС цепи: 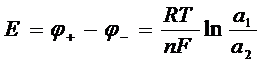 , т.к. активность катионов металла в растворе аМ+ = const и Е0 = j0+ - j0- = 0
, т.к. активность катионов металла в растворе аМ+ = const и Е0 = j0+ - j0- = 0
Газовые цепи – состоят из двух одинаковых газовых электродов с различным давлением газа:
(-) Pt, H2 êHCl êH2, Pt (+) p’H2 > p’’H2
Электродные реакции: (+) 2H+ + 2e ® H2 – восстановление (-) H2 – 2e ® 2H+ - окисление
Электродный потенциал каждого электрода: 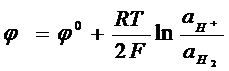
Суммарный процесс состоит в выравнивании давлений газа.
ЭДС цепи: 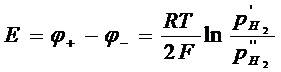 , т.к. аН+ = const
, т.к. аН+ = const
Концентрационные цепи с переносом – состоят из двух одинаковых электродов с различной активностью электролитов. Между двумя растворами электролита имеется граница соприкосновения (диафрагма, мембрана, солевой мост).
В катионных концентрационных цепях с переносом оба электрода обратимы по катиону:
(-) Ag êAgNO3 êêAgNO3 êAg (+) электроды I рода а1 < а2 Е = j+ - j- + jдиф
(-) Pt, H2 êHCl êêHCl êH2, Pt (+) газовые электроды а1 < а2
ЭДС цепи 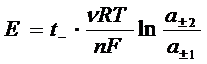 если
если 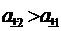
где t - - число переноса аниона; n - число ионов, на которое диссоциирует 1 молекула электролита; а± - средняя активность ионов.
В анионных концентрационных цепях с переносом оба электрода обратимы по аниону:
(-) Ag, AgClêKCl êêKCl ïAgCl, Ag (+) электроды II рода а1 < а2
(-) Pt, Cl2 êHCl ê êHCl êCl2, Pt (+) газовые электроды а1 < а2
ЭДС цепи 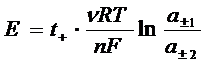
 2018-01-21
2018-01-21 657
657








