Критическая конфигурация – это конфигурация из реагирующих атомов или молекул, представляющих промежуточное состояние в элементарном акте химической реакции.
А+В Û[А-В]¹®АВ Например: Н2+I2®2НI


 Н I H I H I
Н I H I H I





 +
+

 H I H I H I
H I H I H I
реагенты активированный комплекс продукт
Активированные комплексы подвержены более интенсивным вращениям и колебаниям, чем любые другие молекулы.
Скорость разрушения активированных комплексов и скорость образования продуктов, т.е. скорость реакции пропорциональна числу активированных комплексов, разрушающихся за единицу времени в единице объема.
Преимущества теории активированного комплекса (ТАК):
ТАС может быть применима к реакциям протекающим в растворах, тогда как теория столкновений хорошо описывает только реакции в газовой фазе.
26)Гомогенный и гетерогенный катализ!
Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе.
В отсутствии катализатора бимолекулярная реакция протекает по схеме:

В присутствии катализатора реакция имеет другой механизм:
1) образование промежуточного соединения АК в результате обратимого взаимодействия между катализатором и одним из исходных веществ:

2)
 |
образование активированного комплекса в результате взаимодействия образовавшегося промежуточного соединения со вторым компонентом реакции:
3)
 |
образование конечных продуктов и регенерация катализатора:
Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими веществами. В каждой гетерогенно-каталитической реакции можно выделить как минимум шесть стадий:
1. Диффузия исходных веществ к поверхности катализатора.
2. Адсорбция исходных веществ на поверхности с образованием некоторого промежуточного соединения:А + В + К ––> АВК
3. Активация адсорбированного состояния (необходимая для этого энергия есть истинная энергия активации процесса):АВК ––> АВК#
4. Распад активированного комплекса с образованием адсорбированных продуктов реакции:АВК# ––> СDК
5. Десорбция продуктов реакции с поверхности катализатора.СDК àС + D + К
6. Отвод продуктов от поверхности катализатора путем диффузии.
Таким образом, и в гетерогенном катализе ускоряющее действие катализатора связано с понижением энергии активации, которое происходит за счет образования реагирующими веществами промежуточных поверхностных соединений на активных участках катализатора.
Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Например, для катализируемой металлическим никелем реакции. СО + Н2 ––> СН4 + Н2О
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов).
31) Закон Рауля и следствия из него.
Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
 барометрическая формула Больцмана.
барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
Δtкип=Э x Смоляльн, где Э – эбуллиоскопическая константа, +0,52.
Δtзам=К x Смоляльн, где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа – разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа – разница между температурой замерзания раствора и температурой чистого растворителя.
32) Растворы электролитов. Теория электролитической диссоциации Аррениуса.
Электролиты – вещества, которые подвергаются электролитической диссоциации, и вследствие чего их расплавы или растворы проводят электрический ток.
К электролитам принадлежат все соли, а также кислотные, основные и амфотерные гидроксиды.
Раствор электролита представляет собой смесь молекул растворителя и сольватированных (ионы растворенного вещества, окруженные соответственно ориентированными диполями растворителя) молекул и ионов растворенного вещества. Относительное количество молекул, распавшихся на ионы, характеризующее степень диссоциации электролита α, зависит от природы растворителя, природы и концентрации электролита, температуры, давления и наличия других электролитов в растворе.
Процесс распада полярного вещества в растворе на ионы называют электролитической диссоциацией (ионного – ионизацией). По способности к электролитической диссоциации электролиты обычно подразделяют на сильные и слабые.К сильным электролитам обычно относят вещества, которые в растворе практически полностью диссоциированы на ионы. Слабыми электролитами считают вещества, степень диссоциации, которых невелика.
Теория электролитической диссоциации и основанная на ней классификация кислот и оснований в полной мере применимы лишь к водным растворам.
Списать с тетради!
35) Электропроводность растворов электролитов!
Электропроводность ("Каппа") раствора - величина, обратная его сопротивлению R, имеет размерность Ом-1. Для проводника постоянного сечения K=kS/l,где S - площадь сечения проводника; l - длина проводника;
Удельной электропроводностью ("каппа") раствора н-ся элект-ть слоя раствора длиной 1 см, заключенного между электродами площадью 1см2. Она выражается в Ом-1. см-1. В системе СИ удельная электропроводность измеряется в Ом-1. м-1.
Эквивалентной электропроводностью ("лямбда") называется электропроводность такого объема раствора, в котором содержится 1 г-экв растворенного вещества; при условии, что электроды находятся на расстоянии 1 см друг от друга, она выражается в Ом-1. см2. г-экв-1. Лямбда=k/C=kV,где V = 1/ C - разведение (или разбавление) раствора, т.е. объем, в котором содержится 1 г-экв растворенного вещества, а C - эквивалентная концентрация (нормальность) раствора. В системе СИ эквивалентная электропроводность выражается в Ом-1. м2. кг-кв-1.
Эквивалентная электропроводность растворов электролитов возрастает с ростом разбавления раствора и при бесконечном разбавлении (т.е. при бесконечно малой концентрации) достигает предельного значения, которое называется эквивалентной электропроводностью раствора при бесконечном разведении.
В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):  ,где
,где  и
и  0 - эквивалентная электропроводность раствора при концентрации С и при бесконечном разведении, A - константа (при данной температуре) для данного электролита и растворителя.
0 - эквивалентная электропроводность раствора при концентрации С и при бесконечном разведении, A - константа (при данной температуре) для данного электролита и растворителя.
В растворах слабых электролитов лямбда и лямбда0 связаны со степенью диссоциации альфа электролита уравнением Аррениуса: лямбда/лямбда0 = альфа.
Кроме того, выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом: 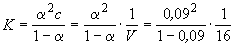 ,где K - константа диссоциации слабого электролита.
,где K - константа диссоциации слабого электролита.
Электропроводность электролитов связана со скоростями движения ионов в растворе. Скорость движения vi [м.с-1] иона в растворе пропорциональна напряженности приложенного электрического поля E [В.м-1]: vi = uiE.
Коэффициент пропорциональности u [м2. с-1. В-1] называется абсолютной подвижностью иона.
Произведение uiF (F - постоянная Фарадея) называется подвижностью иона  i [Ом-1. м2. кг-экв-1]:
i [Ом-1. м2. кг-экв-1]:  i = uiF.
i = uiF.
Подвижность иона при бесконечном разбавлении называется предельной подвижностью иона и обозначается лямбда0.
Согласно закону Стокса, предельная подвижность  0 иона с зарядом z и радиусом r в растворителе с вязкостью h описывается формулой:
0 иона с зарядом z и радиусом r в растворителе с вязкостью h описывается формулой:  ,
,
где e - элементарный заряд, F - постоянная Фарадея.
 2018-01-21
2018-01-21 545
545








