| Квантовое число | Символ | Описание | Значения |
| Главное | n | Энергетический уровень орбитали | Положительные целые числа:1, 2, 3... |
| Орбитальное | l | Форма орбитали | Целые числа от 0 до n-1 |
| Квантовое | m | Ориентация | Целые числа от -l до +l |
| Спиновое | ms | Спин электрона | +½ и -½ |
В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями (эдакие "электронные облака" - области пространства в которых существует вероятность пребывания электрона).
Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми:
Главное квантовое число n
Описывает:
-среднее расстояние от орбитали до ядра;
-энергетическое состояние электрона в атоме.
Чем больше значение n, тем выше энергия электрона и больше размер электронного облака. Если в атоме несколько электронов с одинаковым n, то они образуют электронные облака одинакового размера - электронные оболочки. Орбитальное квантовое число l (азимутальное)
Описывает форму орбитали, которая зависит от n. Орбитальное число l может принимать целочисленные значения в диапазоне от 0 до n-1. Например, при n=2: l=0 l=1
| Значение l определяет форму орбитали, а n - ее размер |
| l | Энергетический подуровень |
| 0 1 2 3 4 | s p d f g |
Орбитали, имеющие одинаковое n, но разные l называют энергетическими подуровнями и обозначают буквами латинского алфавита:
Состояние электрона в атоме для различных главных и орбитальных квантовых чисел принято записывать следующим образом: 2s; 3p; 3d…
Магнитное квантовое число m
Описывает ориентацию орбиталей в пространстве.
Может принимать целочисленные значения в диапазоне от -l до +l (включая 0). Например:
Для l=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию.
Для l=1: m=-1;0;+1 - p-орбиталь имеет три пространственные ориентации.
Для l=2: m=-2;-1;0;+1;+2 - d-орбиталь имеет пять пространственных ориентаций.
Спиновое квантовое число ms
Описывает направление вращения электрона в магнитном поле - по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½.
Квантовые числа для первых трех энергетических уровней:
| n | l | Орбиталь | m | ms |
| 1s | +½ -½ | |||
| 2s | +½ -½ | |||
| 2p | -1 0 +1 | +½ -½ +½ -½ +½ -½ | ||
| 3s | +½ -½ | |||
| 3p | -1 0 +1 | +½ -½ +½ -½ +½ -½ | ||
| 3d | -2 -1 0 +1 +2 | +½ -½ +½ -½ +½ -½ +½ -½ +½ -½ |
На первом уровне (n=1) есть только s-орбиталь, на которой может находиться только 2 электрона со спинами +1/2 и -1/2. Это справедливо для s-орбитали любого уровня: 1s; 2s; 3s…
На втором энергетическом уровне (n=2) есть уже две орбитали s; p. На третьем (n=3) - три орбитали: s, p, d. и т.д. С каждым новым энергетическим уровнем добавляется новая орбиталь.
Для 2p-орбитали существует три пространственных ориентации (формы облака), на каждой из которых может находиться по два электрона. Т.е. на втором энергетическом может находиться не более 6 p-электронов.
Для 3d - максимум 10 d-электронов и пять форм облаков.
Главные энергетические уровни отличаются энергией. Чем выше уровень - тем выше энергия. С другой стороны, различные орбитали одного и того же уровня также обладают разной энергией:
Энергия электронов на орбитали 2p выше, чем на 2s
Энергия электронов на орбитали 3p выше, чем на 3s
Энергия электронов на орбитали 3d выше, чем на 3s
Энергия электронов на орбитали 3d выше, чем на 3p
Что же касается электронов "внутри орбиталей", то их энергии одинаковы (так у всех десяти электронов 3d-орбитали энергии одинаковы).
2) Энергетическую диаграмму электронных состояний в многоэлектронных атомах с помощью уравнения Шредингера в общем случае найти невозможно, так как электрон находится в поле не только ядра, но и других электронов. Поэтому для получения такой диаграммы применяются приближенные методы: для атомов с относительно большим количеством электронов – метод Томаса-Ферми, для легких атомов – метод самосогласованного поля (метод ССП) и т.д. Принципиальные результаты этих методов приводят к такой диаграмме:

Электроны заполняют орбитали в соответствии с принципом минимума энергии – орбиталь с меньшей энергией заполняется раньше орбитали с большей энергией. Порядок заполнения электронов орбиталями определяется квантовыми числами.
Если посчитать сумму n + l для каждой орбитали, то окажется, что меньшей энергии соответствует та орбиталь, для которой сумма n + l меньше. Для орбиталей с одинаковой суммой n + l меньшей энергией обладает та, у которой главное квантовое число n меньше (это наблюдение нередко называют правилом Клечковского):
| Уровень n | Подуровень n,l | Сумма n + l |
| n=1 | l=0 (s) | |
| n=2 | l=0 (s) l=1 (p) | |
| n=3 | l=0 (s) l=1 (p) l=2 (d) | |
| n=4 | l=0 (s) l=1 (p) l=2 (d) l=3 (f) |
Принцип (запрет) Паули: в атоме не может быть двух электронов с одинаковыми значениями квантовых чисел. Следствие из этого принципа налагает ограничение на количество электронов, находящихся на данном энергетическом уровне n – всего их может быть не более 2 n 2.
Правило Хунда: на орбитали электроны располагаются так, чтобы их суммарный спин был максимальным.
Формулировка правила Клечковского
Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Правило Клечковского гласит:
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел  . При одинаковой сумме раньше заполняется орбиталь с меньшим значением . При одинаковой сумме раньше заполняется орбиталь с меньшим значением  . .
|
Эта энергетическая последовательность легко может быть описана при помощи эмпирического правила суммы двух первых квантовых чисел, разработанного в 1951-м году В. М. Клечковским и иногда называемого правилом (n + l). Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы  . Суть его очень проста:
. Суть его очень проста:
орбитальная энергия последовательно повышается по мере увеличения суммы  , причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа
, причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа  . Например, при
. Например, при  орбитальные энергии подчиняются последовательности
орбитальные энергии подчиняются последовательности  , так как здесь для
, так как здесь для  -орбитали главное квантовое число наименьшее
-орбитали главное квантовое число наименьшее  , для
, для  -орбитали
-орбитали 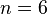 ; наибольшее
; наибольшее 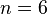 ,
,  -орбиталь занимает промежуточное положение
-орбиталь занимает промежуточное положение  .
.
Или же:
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа  и побочного (орбитального) квантового числа
и побочного (орбитального) квантового числа  , т.е.
, т.е.  , имеет меньшее значение.
, имеет меньшее значение.
2.2
1) Периодический закон и Периодическая система химических элементов
Открытие Периодического закона
В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
В 1869 г. Д. И. Менделеев на основе анализа свойств простых веществ и соединений сформулировал Периодический закон:
Свойства простых тел... и соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.
На основе периодического закона была составлена периодическая система элементов. В ней элементы со сходными свойствами оказались объединены в вертикальные столбцы — группы. В некоторых случаях при размещении элементов в Периодической системе приходилось нарушать последовательность возрастания атомных масс, чтобы соблюдалась периодичность повторения свойств. Например, пришлось "поменять местами" теллур и йод, а также аргон и калий.
Причина состоит в том, что Менделеев предложил периодической закон в то время, когда не было ничего известно о строении атома.
После того, как в XX веке была предложена планетарная модель атома, периодический закон формулируется следующим образом:
Свойства химических элементов и соединений находятся в периодической зависимости от зарядов атомных ядер.
 2018-01-21
2018-01-21 789
789








