Свойства
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, какфтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+ образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
15)металлическая связь
3 Металлическая связь.Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла.
Металлическая связь – связь между плотно упакованными положительными ионами в кристаллах металлов, осуществляемая за счёт притяжения валентных электронов (электронный газ).
Металлическая связь отличается от ковалентной по прочности: её энергия в 3-4 раза меньше энергии ковалентной связи. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100 – 500 кДж/моль. Энергия связи – энергия, необходимая для разрыва химических связей во всех молекулах, составляющих один моль вещества.
18)скорость химических реакции
3.8.1 Скорость химической реакции
Различают два типа химических реакций: гомогенные и гетерогенные. К гомогенным
относятся реакции, у которых и исходные вещества и продукты реакции находятся в одной фазе.
Взаимодействие веществ в таких реакциях происходит по всему объему. К гетерогенным реакциям относят реакции, протекающие на границе раздела фаз.
Скорость реакции по i-му веществу в гомогенной системе определяется как количество i-го вещества, образующегося в единице реакционного объема в единицу времени:
Если реакция протекает изохорически, т.е. объем во время реакции не меняется поскольку концентрация и объем связаны соотношением
28Размерность скорости – моль/(л⋅с). Опытами установлено, что скорость реакции зависит от природы реагирующих веществ, концентрации, давления, температуры, т.е. v = f (C,P,T...).
Раскрытие этой зависимости и составляет одну из задач кинетики.
1) Влияние концентрации на скорость реакции.
Зависимость скорости реакции от концентрации реагирующих веществ можно проиллюстрировать следующим положением теории вероятности: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для того чтобы произошло химическое взаимодействие, например реакция:
А+ В → продукты, необходимо, но не достаточно, столкновение реагирующих молекул А и В, т.е. одновременное нахождение их в определенной точке реакционного пространства.
Вероятность нахождения для молекулы каждого из веществ прямо пропорциональна количеству молекул в единице объема, т.е. его концентрации. Не все столкновения приведут к реакции, а лишь их некоторая доля, величина которой зависит от температуры и природы реагирующих веществ, поэтому скорость реакции равна:
A B v k = C CЧ.
Постоянную k не зависимую от концентрации и зависящую только от температуры и природы реагирующих веществ, называют константой скорости химической реакции.
Физический смысл константы скорости можно установить, если принять все концентрации равными единице. Тогда
v = k.
Константа скорости химической реакции есть скорость реакции при концентрациях реагирующих веществ, равных единице. По известным величинам (k) сравнивают скорости различных реакций.
Пусть протекает химическая реакция, записанная в общем виде:
аА+ вВ +... → продукты.
Тогда зависимость скорости реакции от концентрации можно выразить соотношением:
Полученное выражение называют законом действия масс или основным постулатом химической кинетики.
Закон действия масс впервые сформулирован в 1864 г. Гульдбергом К.М. и Вааге П.:
При постоянной температуре скорость данной реакции прямо пропорциональна произведению концентраций реагирующих веществ, причем каждая из концентраций участвует в степени, в простейших случаях равной коэффициенту перед формулой данного вещества в уравнении реакции.
2) Влияние температуры на скорость химических реакций
Скорость химической реакции зависит не только от концентрации, но и от температуры.
Как показывает опыт, скорость большинства реакций увеличивается при повышении температуры
в 2 ÷ 4 раза на каждые 10 градусов.
Приближенной характеристикой зависимости скорости реакции от температуры является коэффициент реакции γ – отношение константы скорости при температуре Т+10 к константе скорости при температуре Т:
Это соотношение, называемое правилом Вант–Гоффа, может быть применено лишь для приблизительных, ориентировочных расчетов. Это правило не выполняется при высоких температурах, когда температурный коэффициент скорости (γ) перестает быть постоянным,
29приближаясь к единице. Однако для узкого интервала температур правило Вант–Гоффа часто бывает полезным.
Расчеты показывают, что увеличение скорости реакции при повышении температуры не может быть объяснимо лишь возрастанием числа столкновений. Это происходит потому, что не каждое столкновение частиц приводит к химической реакции. Лишь тогда, когда сталкивающиеся молекулы обладают определенной энергией, столкновение может быть эффективным и привести к химической реакции. Эти предположения были впервые высказаны А. Аррениусом. Согласно ученому, к реакции приводит столкновение лишь тех молекул, энергия которых больше определенной величины Еа.
Таким образом, химическое взаимодействие осуществляется только между соударяющимися молекулами, которые достигли определенного энергетического уровня, характерного для данной реакции, ее энергетического барьера. Такие молекулы часто называют активными.
На основе взглядов Аррениуса была разработана теория активных соударений на базе молекулярно-кинетических представлений. Предложено считать активными столкновения, в которых суммарная энергия сталкивающихся возбужденных молекул А* и В* равна или больше Еа.
При столкновении молекулы сближаются до расстояния, которое называется эффективным диаметром столкновений и при котором электроны и атомы одной молекулы попадают в поле действия электрических сил, возбуждаемых частицами другой молекулы. Только при таких условиях может произойти разрыв связей в исходных веществах и образование новых молекул.
Все молекулы, запас энергии которых не ниже энергетического барьера реакции, находятся в особом состоянии, которое принято называть переходным, или состоянием активированного комплекса. Можно предположить, что система в состоянии активированного комплекса характеризуется тем, что в ней уже нет исходных веществ, но нет еще и продуктов реакций; исходные вещества переходят в продукты реакции.
Покажем схематически переход от исходных веществ А и В к продуктам реакции С и Д через состояние активированного комплекса А….В
Примем средний уровень энергии молекул исходных веществ в системе равным Е1, а среднюю энергию переходного состояния – Е|, то разность Е|- Е1 будет выражать энергию активации данной реакции – Еа. Энергия системы в переходном состоянии максимальна, а это значит, что активный комплекс крайне неустойчив. По ходу реакции он превращается в продукты взаимодействия С и D. В рассматриваемом примере средний уровень энергии молекул продуктов реакции Е2 ниже среднего уровня энергии молекул исходных веществ Е1. Это означает, что процесс протекает с выделением энергии (реакция экзотермическая).
Средний уровень энергии молекул продуктов реакции Е2 может быть выше среднего уровня энергии молекул исходных веществ Е1.
Процесс протекает с поглощением энергии (реакция эндотермическая). Разность Е2 – Е1 равна тепловому эффекту процесса ΔН.
В химической кинетике часто пользуются уравнением Аррениуса в логарифмической форме:
19) Молекулярность и порядок реакции
Число молекул, вступающих в реакцию, определяют молекулярность реакции.
Так, если в реакцию вступает одна молекула, то такая реакция называется молекулярной реакцией. Если в реакции участвуют две молекулы (безразлично, одинаковые или нет), то такая реакция называется бимолекулярной. Встречаются также тримолекулярные реакции.
Реакции более высокой степени молекулярности крайне редки из–за малой вероятности одновременного столкновения большого числа молекул.
Поэтому большинство реакций протекают в несколько элементарных, простых стадий, в которых участвует небольшое число молекул.
Так, например, рассмотренная выше реакция
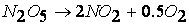
протекает по следующему механизму:
первая стадия
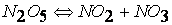
вторая стадия (медленная)
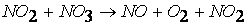
третья стадия
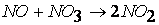
Определить такие стадии – значит определить механизм, или путь реакции.
Скорость всей реакции определяется скоростью её наиболее медленной стадии, которая и определяет механизм.
Поэтому закон действующих масс справедлив только для таких элементарных стадий.
Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально.
Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции.
Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
H2 + I2 ® 2HI.
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции
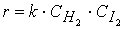
В подавляющем большинстве случаев порядок реакции по веществу отличается от стехиометрических коэффициентов уравнения реакции для этого вещества.
Соответственно общий порядок реакции обычно не равен сумме стехиометрических коэффициентов уравнения реакции.
Например, реакция
NO2 + CO ® CO2 + NO,
при температурах, меньших 298К, протекает по следующему механизму:
первая стадия процесса: NO2 + NO2 ® NO3 + NO
вторая стадия процесса: NO3 + CO ® CO2 + NO2,
причем лимитирующей, т.е. скорость определяющей стадией является первая стадия процесса:
NO2 + NO2 ® NO3 + NO
Тогда, согласно первому постулату химической кинетики, который утверждает, что скорость всей реакции равна скорости его самой медленной стадии, можно записать:
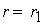 ,
,
где 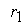 - скорость первой стадии процесса.
- скорость первой стадии процесса.
Согласно второму постулату химической кинетики, который утверждает, что скорость элементарной (одностадийной) реакции пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам, получим зависимость скорости реакции
NO2 + CO ® CO2 + NO
от концентрации реагирующих веществ:
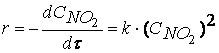
Обратите внимание, что скорость реакции
NO2 + CO ® CO2 + NO
не зависит от концентрации оксида углерода CO.
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции в дифференциальной форме.
К сожалению, кинетическое уравнение реакции может быть получено только при её экспериментальном изучении и не может быть выведено из стехиометрического уравнения.
20) Энергия активации
Необходимым этапом многих химических превращений является столкновение молекул. Однако подсчет числа столкновений, выполненный при помощи кинетической теории, показал, что далеко не каждое столкновение ведет к реакции. С. Аррекиус высказал мысль, что реакционноспособными являются не все, а только активные молекулы. Для того чтобы при столкновении произошла химическая реакция, молекулы в момент столкновения должны иметь некоторый избыток энергии над средней энергией.
Избыточная энергия называется энергией активации. Именно в результате этого многие реакции, которые вполне возможны, задерживаются или практически не протекают. Чем больше энергия активации, тем медленнее при данной температуре идет реакция; снижение энергии активации вызывает увеличение скорости процесса. Аррениус выразил зависимость константы скорости от температуры уравнением
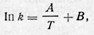
где А и В — константы, характерные для данной реакции.
С другой стороны, константа равновесия при постоянных р и Т, равная соотношению скоростей прямой и обратной реакций, зависит от температуры следующим образом:
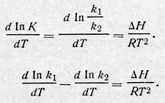
Но теплоту реакции ∆Н при р = const можно представить как разность энергии активации прямой и обратной реакций:
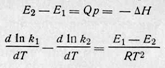
Можно предположить, что вообще существует зависимость
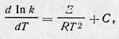
где С — константа, одинаковая для прямой и обратной реакций. Аррениус показал, что С = 0. В этом случае интегрирование дает:
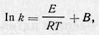
где В — константа интегрирования. Таким образом,
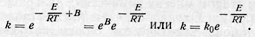
Уравнение выше выражает зависимость константы скорости реакции от величины энергии активации и температуры. Для определения энергии активации строят график зависимости логарифма константы скорости In k от обратной температуры 1/Т. При этом, если закон, выраженный уравнением Аррениуса, выполняется, получается прямая линия. Действительно,
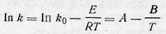
в координатах in k—1/Т есть уравнение прямой. Тангенс угла наклона прямой tg ᵩ дает значение E/R, а отрезок, отсекаемый прямой на оси ординат, равен In k0. Расчет можно произвести и аналитически. Для этого измеряют константу скорости при двух различных температурах Т1 и Т2 и суммируют выражение для Ink:
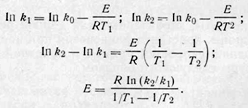
Обычно пользуются десятичными логарифмами, т. е. употребляют уравнение
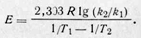
Энергию активации выражают в Дж/моль. Изучение вопроса о физической природе энергии активации привело к выводу, что активными являются не только молекулы, обладающие повышенной скоростью поступательного движения. Активация молекулы может осуществляться в результате перехода атомов, входящих в ее состав, на повышенные колебательные уровни или в результате возбуждения электронов. В соответствии с этим и факторы, способствующие появлению активных молекул, различны по своей природе. Наиболее часто причиной активации следует считать столкновение молекул.
В некоторых реакциях причиной активации является поглощение электромагнитных колебаний, в частности, видимого света. Электрический разряд, воздействие ультразвуком, разрывы валентных связей также могут вызывать активацию. Энергия активации зависит от температуры.
Активационные барьеры ограничивают возможности развития реакций. При решении практических задач часто стремятся повысить энергию активации одного процесса и понизить энергию активации другого,» так как это позволяет управлять ходом сложного химического превращения. Снижение энергии активации, вызываемое катализаторами, в большинстве случаев наиболее характерный признак каталитической активности. В природе биокатализаторы, т. е. ферменты, снижают энергию активации иногда на целый порядок (такова, например, каталаза, разлагающая пероксид водорода).
Таким образом, лекарственные вещества, полностью и избирательно ингибирующие активность отдельных ферментов, могут значительно повышать энергию активации. Согласованное действие ферментов и их высокая специфичность делают ферментные системы одним из наиболее совершенных средств для целенаправленного управления множеством реакций в организмах.
21)катализаторы.
3.8.5 Катализ
Катализом называют явление изменения скорости химической реакции под воздействием катализаторов. Реакции, протекающие с участием катализаторов, называют каталитическими.
Катализатор – это вещество, взаимодействующее с молекулами реагирующих веществ, изменяющее скорость химической реакции и выделяющееся на последующих стадиях в химически неизменном виде.
Катализатором могут изменять скорости реакции в миллионы и большее число раз, как в ту, так и в другую сторону. Под действием катализаторов могут возбуждаться реакции, которые без них фактически не происходят в данных условиях. Если скорость реакции в присутствии катализатора увеличивается, то катализ считается положительным; если скорость реакции уменьшается, то катализ отрицательный. Катализатор, замедляющий скорость химической реакции, называют ингибитором.
Если катализатором является один из продуктов реакции, то реакцию называют автокаталитической, а само явление – автокатализом.
Например, при окислении Fe2+ с помощью MnO-
5Fe2+ + MnO-
4 + 8H+
= 5Fe3+ + Mn2- + 4H2O
образующиеся ионы Mn2- катализируют ход реакции;или реакция окисления сложного эфира:
СН3СООС2Н5 + Н2О → С2Н5ОН + СН3СООН.
Катализатором этой реакции являются ионы Н+, которые появляются в растворе при диссоциации получающейся уксусной кислоты.
Каталитические реакции очень распространены в природе. Многие из них катализируются ферментами. Каталитические процессы широко используются в промышленности. Производство азотной и серной кислот, аммиака, получение синтетического каучука и т.д. невозможны без катализатора.
В качестве катализаторов используют оксиды Mn(IV), Ni, Co, Fe, AlCl3, TeCl3. Катализаторами могут быть атомы, молекулы, ионы.
34Рассмотрим общие закономерности катализа:
1. Катализатор активно, за счет химических связей (ковалентных, водородных) или электростатического взаимодействия, участвует в элементарном акте реакции. Он образует либо промежуточное соединение с одним из участников реакции, либо активированный комплекс со всеми реагирующими веществами. После каждого химического акта он регенерируется и может вступать во взаимодействие с новыми молекулами реагирующих веществ.
2. Катализатор обладает избирательностью действия, т.е. он может изменять скорость одной реакции и не влиять на скорость другой.
3. Действие катализатора сводится к понижению энергии активации.
4. Катализатор не влияет на положение термодинамического равновесия, т.е. на значение
константы равновесия, равное отношению констант прямой и обратной реакций:
Он в одинаковой степени изменяет константы скорости прямой и обратной реакций и только ускоряет наступление равновесия.
Различные каталитические реакции принято разделять на реакции гомогенного и гетерогенного катализа.
Гомогенный – это такой катализ, когда катализатор и все реагирующие вещества находятся в одной фазе.
Гомогенный катализ в растворах наиболее часто вызывается действием водородных и гидроксильных ионов. Каталитическое действие кислот было открыто в 1811 г. К. Кирхгофом.
Инверсия сахара, омыление сложных эфиров, гидролитическое разложение амидов, ацеталей и много других реакций в растворах ускоряются действием водородных ионов, причем с повышением их концентрации примерно пропорционально увеличивается и скорость.
К гетерогенным относятся каталитические процессы, протекающие на границе раздела фаз Т-Г, Т-Ж. При гетерогенном катализе реакция протекает на поверхности катализатора. Поэтому площадь поверхностного слоя катализатора и его строение определяют активность катализатора.
Гетерогенный катализ находит большее применение в промышленности, чем гомогенный.
В качестве гетерогенных катализаторов используют переходные металлы, металлы первой группы, фосфорную кислоту. Гетерогенный катализ имеет свои особенности:
1) катализатор представляет собой совокупность большого количества молекул и атомов, образующих отдельную твердую фазу;
2) из большого количества атомов и молекул только небольшая часть расположена на поверхности и может взаимодействовать с молекулами реагирующих веществ;
3) молекулы и атомы, принимающие участие в элементарном каталитическом акте, сосредоточены у поверхности катализатора в очень малом объеме по сравнению с общим объемом жидкой фазы.
Всякое увеличение неоднородности поверхности должно усиливать активность катализатора. Это достигают на практике введением в катализатор некоторых веществ, которые сами не являются катализаторами, но, изменяя структуру поверхности, увеличивают активность катализатора. Такие вещества называются промоторами.
Активность гетерогенного катализатора резко уменьшается при отравлении его ядами.
Например, платина легко отравляется соединениями мышьяка, серы, фосфора. Отравление катализаторов обусловлено блокированием активных центров за счет образования связи между молекулами яда и поверхностью катализатора.
22)химическое равновесие. Принцып ле Шателье
3.6 Химическое равновесие
Под химическим равновесием понимают неизменное во времени состояние системы, содержащей исходные вещества и продукты реакции, рассматриваемое при постоянных давлении, объеме и температуре. Выделяют следующие признаки равновесия:
1. При неизменных внешних условиях состав системы сохраняется сколь угодно долго.
2. К состоянию равновесия система может прийти как при протекании прямой, так и обратной реакций.
3. При любом внешнем воздействии система приходит к новому состоянию равновесия. При прекращении воздействия, система возвращается к прежнему состоянию равновесия.
Истинное химическое равновесие является динамическим, так как скорости прямой и обратной реакций не равны нулю, а нулю равна наблюдаемая скорость процесса.
Химическая реакция может быть обратимой и необратимой. В необратимых реакциях теоретический выход продукта равен единице, так как реагенты, взятые в стехиометрических количествах полностью превращаются в продукты (труднорастворимые вещества, выпадающие в осадок, газ, удаляемый из сферы реакции (малодиссоциирующее вещество). Необратимая химическая реакция самопроизвольно протекает только в одном направлении, отвечающем превращению исходных веществ в продукты. Для обратимых реакций самопроизвольными являются как прямой, так и обратный процесс.
Для того, чтобы рассчитывать химические равновесия, т.е. определять состав равновесной смеси, надо конкретизировать вид зависимости химического потенциала реагентов и продуктов от переменных, выражающих состав, p и T. Рассмотрим реакцию
a A + bB = cC + dD, (I)
протекающую в газовой фазе при постоянной температуре T. Пусть все реагенты представляют собой идеальные газы.
было выведено Вант-Гоффом (1886 г.) и называется уравнением изотермы реакции
Гиббса реакции, парциальные давления участников которой равны 1 бар, а pi – относительные парциальные давления реагирующих веществ в момент их смешения. При достижении равновесия
Под знаком логарифма в квадратных скобках стоит произведение равновесных значений
парциальных давлений продуктов и реагентов в степенях, равных стехиометрическим коэффициентам. Это произведение принято называть константой равновесия химической реакции
Константа Kp выражена через парциальные давления идеальных газов и зависит только от температуры. С учетом константы равновесия уравнения можно переписать в виде
Эти выражения играют чрезвычайно важную роль в прикладной термодинамике:• используя справочные данные для расчета ∆rGo, можно, не проводя эксперимента, 27определить равновесный состав смеси;• если известны стандартная энергия Гиббса реакции (или константа равновесия) и парциальные давления реагирующих веществ в момент их смешения, можно по знаку ∆rG судить о направлении процесса.
3.7 Смещение химического равновесия. Принцип Ле-Шателье
Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
23) Растворы
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается ΔS < 0, а при растворении кристаллов возрастает (ΔS > 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
Концентрация насыщенного раствора определяется растворимостью вещества при данной температуре. Растворы с меньшей концентрацией называются ненасыщенными.
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
Химическая теория растворов
Процесс образования растворов самопроизволен. Всякое чистое вещество самопроизвольно загрязняется за счет поглощения посторонних веществ. Одна из причин процесса растворения - химическое взаимодействие частиц растворенного вещества с молекулами растворителя с образованием сольватов (или гидратов, если растворителем является вода). Также причиной самопроизвольности процессов растворения является увеличение степени беспорядка системы (энтропии) при переходе от чистых веществ к раствору.
Гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав кристаллов, образуя кристаллогидраты, а входящая в их состав вода называется кристаллизационной.
Сольваты обычно менее прочны, чем большинство химических соединений. Однако когда тепловой эффект сольватации превышает теплоту разрушения кристаллической решетки растворяемого вещества, растворение сопровождается выделением теплоты.
Прочность сольватов определяется силами взаимодействия между растворителем и растворенным веществом. Сольваты образуются за счет ион-дипольного, диполь-дипольного и донорно-акцепторного взаимодействия, а также за счет образования водородных связей.
Д. И. Менделеев разработал химическую теорию растворов, в основе которой лежат представление об определяющей роли сольватации при растворении веществ.
Растворение многих веществ сопровождается не выделением, а поглощением теплоты. Это значит, что на разрушение кристаллической решетки затрачивается больше энергии, чем выделяется при сольватации. Тепловой эффект процесса растворения - это сумма теплоты, необходимой для разрушения кристаллической решетки вещества и теплоты, выделяющейся в процессе сольватации.
Вещества, находящиеся в чистом состоянии, самопроизвольно стремятся перейти в раствор. Исследования свойств растворов, предпринятые на рубеже XIX - XX вв. привели к созданию так называемой физической теории растворов, построенной на аналогии между растворами и смесями газов. При этом предполагалось, что молекулы растворенного вещества и растворителя в известной мере индифферентны (безразличны) по отношению друг к другу.
Физическая теория растворов является противоположностью химической теории Д. И. Meнделеева. Однако, хотя физическая теория хорошо описывала поведение растворов неэлектролитов - веществ, растворы которых не проводят электрический ток, все попытки применения найденных закономерностей по отношению к растворам электролитов - веществ, растворы которых проводят электрический ток, были безуспешными.
В настоящее время выяснилось, что обе теории были в равной степени правы и сейчас процесс растворения рассматривается как физико-химический процесс, а растворы - как физико-химические системы.
24) Способы выражения концентраций растворов
Массовая доля вещества
Массовая доля обозначается греческой буквой "омега" и равна отношению массы растворенного вещества к общей массе раствора
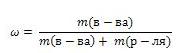
Выражают обычно в массовых долях или процентах (для этого в формуле правую часть домножают на 100%).
 2018-01-21
2018-01-21 545
545







