Типичные окислители:F2, Cl2, Br2, I2, O2, H2SO4, HNO3,MnO2, KMnO4, K2CrO4, NaClO. Типичные восстановители:Н2, C, металлы, Н2S, CO, SO2, HI, FeSO4.
35. Стандартный (нормальный) окислительно-восстановительный потенциал, определение направления о.-в. реакцииОкислительно-восстановительный потенциал — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ).Окислительно-восстановительный потенциал – величина, характеризующая окислительно-восстановительную способность (силу) окислителя и восстановителя, составляющих соответствующую полуреакцию.Стандартные окислительно-восстановительные потенциалы – ОВ потенциалы, измеренные при стандартных условиях (температура 25°С, давление 1 атм.)Стандартные ОВ потенциалы применяются для расчета констант равновесия ОВ реакций. Ими можно пользоваться для приближения определения возможности осуществления ОВ реакций.
Вычисление
 ,
,
Где
·  — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
·  — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
·  — абсолютная температура;
— абсолютная температура;
·  — постоянная Фарадея.
— постоянная Фарадея.
·  — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
· 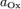 и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
· E°ox/red = - ∆G°/nF
Определение направления ОВР:
∆E°p=E°окислителя − Е°восстановителя
Значения E°окислителя и Е°восстановителя берем из таблицы стандартных потенциалов.
Если ∆E°p больше 0, то реакция протекает в прямом направлении.
 2018-01-21
2018-01-21 750
750








