1. Понятие о дисперсных системах. Дисперсная фаза, дисперсионная среда. Классификации и примеры дисперсных систем.
2. Защитные покрытия металлов от коррозии. Анодные и катодные покрытия.
Ответ:
Дисперсными называют такие системы, в которых одно или несколько веществ в виде мелких частиц распределены в другом веществе.
При этом распределяемое вещество принято называть дисперсной фазой, а вещество, в котором происходит распределение, - дисперсной средой.
| Дисперсная среда | Дисперсная фаза | Примеры |
| Газ | газ жидкость твердое тело | газовые смеси (воздух) туманы, облака пыль, дым |
| Жидкость | газ жидкость твердое тело | пена эмульсии (молоко, кремы, мази), суспензии, взвеси (глина в воде) |
| Твердое тело | газ жидкость твердое тело | твердые пены(пенопласты, пемза, пеностекло) твердые эмульсии (вода в парафине, жемчуг) сплавы, твердые растворы |
| Дисперсные системы | Размеры частиц дисперсной системы | Устойчивость и гомогенность системы |
| Грубодисперсные (суспензии, взвеси) | 10-3…10-5 см (10…0,1 мкм) | Неустойчивы, гетерогенны |
| Тонкодисперсные (коллоидные растворы) | 10-5…10-7 см (0,1…0,001 мкм) | Довольно устойчивы, микрогетерогенны |
| Молекулярно-дисперсные (истинные растворы) | ~10-8 см (размер молекул и ионов) | Весьма устойчивы, гомогенны |
Защитные покрытия:
Металлические
Химические
Неметаллические
- Неорганические (эмали)
- Органические (лаки, краски, пластмассы, смолы, битум, асфальт)
Анодное покрытие – покрытие металлом, с более отрицательным потенциалом
Оцинкованное железо
А(–) Zn – 2e– → Zn2+
K(+) (Fe) 2H+ + 2e– → H2
Катодное покрытие – покрытие металлом, с более положительным потенциалом
Луженое железо
А(–) Fe – 2e– → Fe2+
K(+) (Sn) 2H+ + 2e– → H2
РЕШЕНИЕ
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г)
Критерием, определяющим возможность самопроизвольного протекания реакции при определённой температуре является изменение значения энергии Гиббса (∆G): 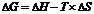 , где ∆H – изменение энтальпии, кДж; Т – абсолютная температура, К; ∆S – изменение энтропии, кДж/К.
, где ∆H – изменение энтальпии, кДж; Т – абсолютная температура, К; ∆S – изменение энтропии, кДж/К.
Если ∆G<0, процесс может идти самопроизвольно, если ∆G>0, то процесс самопроизвольно не идет. При ∆G=0 устанавливается равновесие.
Cтандартные энергии Гиббса образования реагентов и продуктов реакции равны:
| вещество | NH3(г) | O2(г) | NO(г) | H2O(г) |
| ΔGо298,Дж/моль | -16,71 | 86,58 | -237,24 |
По закону Гесса изменение энергии Гиббса(ΔrG°298) химической реакции при стандартных условиях можно найти исходя из формулы: 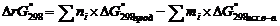 ,где ni и mi – число молей продуктов и исходных веществ, принимающих участие в реакции.
,где ni и mi – число молей продуктов и исходных веществ, принимающих участие в реакции.
Вычислим изменение энергии Гиббса реакции в стандартных условиях: 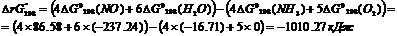
Т.к. значение ∆G<0, то реакция при стандартных условиях будет протекать в прямом направлении.
 2018-01-21
2018-01-21 748
748








