Молярная концентрация (С) – число молей растворенного вещества в одном литре раствора.
Моляльная концентрация (Сm) – число молей растворенного вещества в одном килограмме растворителя.

 Процентная концентрация (ω) – число граммов растворенного вещества в 100 граммах раствора.
Процентная концентрация (ω) – число граммов растворенного вещества в 100 граммах раствора.
Скорость реакции.
 Скорость реакции изменение концентрации реагентов или продуктов реакции в единицу времени
Скорость реакции изменение концентрации реагентов или продуктов реакции в единицу времени
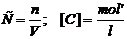 Средняя скорость – конечное изменение концентрации с2-с1, относящееся к промежутку времени t2-t1
Средняя скорость – конечное изменение концентрации с2-с1, относящееся к промежутку времени t2-t1
Истинная (мгновенная) скорость – первая производная концентрации по времени
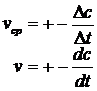 |
Скорость реакции зависит:
• от природы реагирующих веществ
• от температуры
• от концентрации
• от давления (для газов)
• от катализатора
• от площади соприкосновения (для гетерогенных реакций)
• от среды (для реакций в растворах)
• от формы сосуда (для цепных реакций)
Основной постулат химической кинетики
1867 г. Гульдберг, Вааге – закон действующих масс:
скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов
aA + bB → сС + dD
V=k[A]a[B]b
РЕШЕНИЕ
Для расчета ЭДС необходимо рассчитать потенциалы электродов по уравнению Нернста:  ,где E0 – стандартный потенциал металла, В; R – универсальная газовая постоянная, 8,31Дж/моль×К; T – температура, 298 К, К; z – число электронов, принимающих участие в электродной реакции; F – число Фарадея, 96500 Кл/моль; [Ме] – концентрация катионов металла, моль/л.
,где E0 – стандартный потенциал металла, В; R – универсальная газовая постоянная, 8,31Дж/моль×К; T – температура, 298 К, К; z – число электронов, принимающих участие в электродной реакции; F – число Фарадея, 96500 Кл/моль; [Ме] – концентрация катионов металла, моль/л.
Приняв концентрации солей металлов равными 1 моль/л, вычислим потенциалы электродов при заданных условиях:
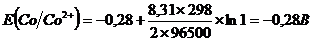

Электрод с меньшим равновесным потенциалом – анод, с большим – катод. Рассчитаем ЭДС гальванического элемента, как разность потенциалов электродов: 
Схема гальванического элемента:
 |
Анод (+) Ti | 1 МTi2+|| 1МCo2+|Co (-) Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
Катодный и анодный процессы в этом гальваническом элементе можно представить в виде уравнений реакций:
Анод: Ti → Ti2+ + 2e |2| 1 - окисление
Катод: Co2+ + 2e → Co|2| 1 - восстановление
Суммарное уравнение реакции:
Ti+ Co2+→ Ti2+ + Co
 2018-01-21
2018-01-21 482
482








