Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Активированный комплекс, группировка атомов в решающий момент элементарного акта химической реакции. Понятием об активированном комплексе широко пользуются в теории скоростей химических реакций.
Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Термин введён Сванте Августом Аррениусом в 1889. Типичное обозначение энергии реакции Ea.
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции K от температуры T.
Согласно простой модели столкновений химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 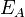 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией  , пропорционально
, пропорционально  . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:

Здесь 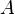 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул,  — универсальная газовая постоянная.
— универсальная газовая постоянная.
В рамках теории активных соударений 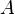 зависит от температуры, но эта зависимость достаточно медленная
зависит от температуры, но эта зависимость достаточно медленная
 2018-01-21
2018-01-21 987
987








