Химическая связь — явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы.
· Энергия связи (для данного состояния системы) — разность между полной энергией связанного состояния системы тел или частиц и энергией состояния, в котором эти тела или частицы бесконечно удалены друг от друга и находятся в состоянии покоя:
 где:
где:
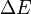 — энергия связи компонентов в системе из i компонент (частиц),
— энергия связи компонентов в системе из i компонент (частиц),
 — полная энергия i-го компонента в несвязаннном состоянии (бесконечно удалённой покоящейся частицы)
— полная энергия i-го компонента в несвязаннном состоянии (бесконечно удалённой покоящейся частицы)
| Вид связи | Энергия связи, кДж/моль | Свойства |
| Ковалентная | Высокие твердость, прочность, температуры кипения и плавления | |
| Ионная | Хрупкость | |
| Металлическая | Высокая пластичность | |
| Водородная | Низкие твердость, прочность, температуры кипения и плавления | |
| Вандерваальсова |
 — полная энергия связанной системы.
— полная энергия связанной системы.
· Длина связи – это расстояние между ядрами взаимодействующих атомов.
Длины химической связи были определены экспериментально для огромного числа молекул.
В большинстве случаев - чем больше энергия связи, тем меньше длина связи.
· Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие
связи, то связь направлена, если таких направлений нет – то ненаправлена.
· Кратность связи - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной
химической связи.
· Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной
плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра.
Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны.
 2018-01-21
2018-01-21 7621
7621
