· Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных.
Пример:
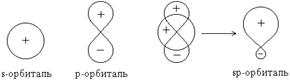
Перекрывание sp-орбиталей бериллия и p-орбиталей хлора в молекуле BeCl2 : 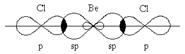
Перекрывание sp2-орбиталей бора и p-орбиталей хлора в молекуле BCl3 : 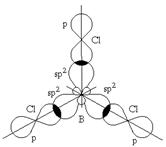
· Конфигурация молекул, в стереохимии характеризует пространственное расположение атомов или групп атомов у асимметрического атома, у несимметрично замещенной двойной связи, у малого (жёсткого) цикла, у центрального атома в комплексах.
Энергетические эффекты химических реакций. Эндо- и экзотермические реакции.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
-Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
-В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO. В термохимии стандартный тепловой эффект реакции рассчитывают с помощью стандартных энтальпий образования.
· Эндотерми́ческие реа́кции (от др.-греч. ἔνδον — внутри и θέρμη — тепло) — химические реакции, сопровождающиеся
поглощением теплоты. Для эндотермических реакций изменение энтальпии и внутренней энергии имеют положительные значения (ΔH > 0, ΔU > 0), таким образом, продукты реакции содержат больше энергии, чем исходные компоненты.
К эндотермическим реакциям относятся:
-реакции восстановления металлов из оксидов,
-электролиза (поглощается электрическая энергия),
-электролитической диссоциации (например, растворение солей в воде),
-ионизации,
-фотосинтеза.
Эндотермические реакции противоположны экзотермическим реакциям.
· Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты. Противоположна эндотермической
реакции.
 2018-01-21
2018-01-21 1473
1473
