· 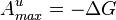 , где
, где 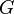 — энергия Гиббса.
— энергия Гиббса.
· Эквивалентная электрическая проводимость максимальна в бесконечно разбавленных растворах, с ростом концентрации - уменьшается, а с повышением температуры - возрастает. [ 1 ]
· Эквивалентная электрическая проводимость для раствора уксусной кислоты при 18 С и разведении 32 м3 / кг-экв равна 0 82 См м2 кг-экв-1. [ 2 ]
· Эквивалентная электрическая проводимость () представляет собой проводимость раствора, помещенного между одинаковыми электродами, расположенными на расстоянии 1 м; при этом площадь электродов должна быть такой, чтобы в объеме раствора между ними содержалась молярная масса эквивалента вещества. [ 3 ]
· Эквивалентная электрическая проводимость имеет размерность См - м2 / моль. Эквивалентная электрическая проводимость, как и удельная электрическая проводимость, зависит от природы электролита и природы растворителя, от температуры, концентрации и степени диссоциации. Механизм влияния указанных факторов на х и X одинаков. [ 4 ]
· Эквивалентная электрическая проводимость представляет электрическую проводимость объема электролита, содержащего 1 г-экв растворенного вещества и находящегося между двумя параллельными электродами, расположенными на расстоянии 1 см друг от друга. [ 5 ]
· Эквивалентные электрические проводимости ионов находят с помощью чисел переноса t и t - (гл. [ 6 ]
· Ионные эквивалентные электрические проводимости находят из справочных таблиц. [ 7 ]
· Эквивалентная электрическая проводимость раствора электролита представляет собой проводимость объема электролита, содержащего 1 эквивалент электролита и находящегося между двумя параллельными электродами, расположенными на расстоянии 1 м один от другого; X зависит от концентрации, причем эта зависимость выражена тем ярче, чем выше концентрация раствора. [ 8 ]
· Эквивалентная электрическая проводимость раствора электролита равна его удельной электропроводности, умноженной на разведение, выраженное в см3 н а 1 г-экв электролита. [ 9 ]
· Эквивалентная электрическая проводимость уксусной кислоты при концентрации 5 91 1 0 - 3 моль / л равна 20 96 - Ю-4 См - м2 / моль. [ 10 ]
· Эквивалентная электрическая проводимость раствора Са (МО3) 2, содержащего 1 моль в 23 81 л, при 25 С равна 9 89 См м2 кг-экв-1. [ 11 ]
· Эквивалентной электрической проводимостью называют проводимость ра - створа, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Ее единицей измерения является См - см1 мольэкв. [
Билет № 51
Вопрос № 1 Ионное произведение воды. Расчет РН для сильных и слабых электролитов
Вода в очень малой степени находится в диссоциированном состоянии (очень слабый электролит): H2O H+ + OH –
К её диссоциации можно применить закон действующих масс: При столь малой константе диссоциации (КД) концентрация воды остается практически неизменной и равной [H2O]=1000/18=55.6 моль/л. Произведение постоянных величин - также постоянная величина: Kд∙[H2O] = [H+]∙[OH–].
Таким образом, произведение молярных концентраций ионов водорода [H+] и гидроксильных групп [OH–] в любом водном растворе есть величина постоянная (при данной температуре) и называется ионным произведением воды(КВ). Диссоциация воды – процесс эндотермический, поэтому ионное произведение воды (КВ) зависит от температуры. С повышением температуры увеличиваются концентрации [H+] и [OH–] ионов и величина ионного произведения В соответствии с теорией электролитической диссоциации ионы H+ являются носителями кислотных свойств, а ионы OH– - носителями основных свойств. Поэтому раствор будет нейтральным, при условии: [H+] = [OH–] =10–7 моль/л; при [H+] > [OH–] – кислым; при [H+] < [OH–] – щелочным.Концентрация катионов водорода [H+] обычно выражается очень малыми величинами. Для большего удобства принято пользоваться отрицательным значением десятичного логарифма молярной концентрации ионов [H+], который назван водородным показателем, и обозначается рН: рН = –lg [H+], где [H+] - молярная концентрация ионов H+. Следовательно: [H+]= 10–pHЕсли реакция среды нейтральная, то [H+] = 10–7 [моль/л], и рН=7. Если реакция среды кислая, то [H+]>10–7 [моль/л], и рН<7. Если среда щелочная, то [H+]<10–7 [моль/л], и рН>7. По аналогии рН введен гидроксильный показатель (рОН): рОН = –lg [ОH-], где [ОH-] - молярная концентрация ионов ОH-. А также показатель константы воды: рКВ = –lg КВ. Логарифмируя ионное произведение воды, получаем выражение: –lg [H+][OH–] = –lg 10–14 и далее: pH + pOH = 14. Кислота(определение по Аррениусу) – это химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительные ионы водорода и отрицательные ионы кислотного остатка.1. Поскольку диссоциация сильной кислоты (HNO3, HCl, H2SO4, HI, HBr, HСlO4) протекает практически полностью, можно считать: [H+] = Скисл., где Скисл - молярная концентрация кислотыРасчет рН сильной кислоты проводят по уравнению рН = - lg а Н+ = - lg f Н+[H+], где а Н+ - активная концентрация, моль/л. 2. При расчете рН слабых электролитов обычно принимают ионную силу раствора (I) равной нулю, коэффициент активности (f) равным 1 и рН = - lg[H+].
HNO2 H+ + NO2– (слабая кислота - слабый электролит) Концентрация ионов водорода в растворе слабых кислот определяют по закону разведения Оствальда:,где α – степень диссоциации кислоты, Скисл – молярная концентрация кислоты, Ккисл – константа диссоциации кислоты, характеризует силу кислоты: чем меньше константа диссоциации, тем слабее кислота.
Вопрос №2 Аналитический сигнал фотометрии. Факторы влияющие на его величину
Фотометрический метод анализа основан на способности определяемого вещества, поглощать электромагнитное излучение оптического диапазона. Поглощение при определенной длине волны является информацией о качественном и количественном составе определяемого вещества и составляет аналитический сигнал. Фотометрический анализ относится к молекулярному абсорбционному анализу, т. е. анализу основанному на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой (УФ), видимой и инфракрасной (ИК) областях спектра Существуют два общих метода фотометрии: 1) визуальная фотометрия, в которой при выравнивании механическими или оптическими средствами яркости двух полей сравнения используется способность человеческого глаза ощущать различия в яркости; 2) физическая фотометрия, в которой для сравнения двух источников света используются различные приемники света иного рода – вакуумные фотоэлементы, полупроводниковые фотодиоды и т.д.
Абсолютное определение интенсивности световых потоков возможно только при помощи фотоэлементов. При определении по абсолютной интенсивности светового потока источник света, кювета с исследуемым раствором и приёмник света располагаются на одной прямой. Это так называемый метод однолучевой фотометрии.
Условия определения концентрации вещества этим методом также описываются законом Бугера – Ламберта – Бэра:
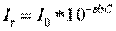
Поскольку фототок пропорционален интенсивности падающего света, то
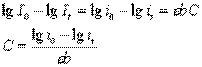
где i0 – фототок, пропорциональный интенсивности света I0
it - фототок, пропорциональный интенсивности света It
Метод однолучевой фотометрии очень прост, но требует постоянства начального светового потока. В фотометрическом анализе однолучевая фотометрия используется в методе пропорциональных отклонений.
При измерении по методу сравнения интенсивностей световой поток от источника света пропускают через две параллельные кюветы, содержащие сравниваемые растворы; лучи, прошедшие через кюветы, попадают на самостоятельные приёмники света. Это так называемый метод двулучевой фотометрии. Сравнение интенсивности световых потоков можно проводить и визуально, человеческий глаз способен улавливать разницу в интенсивностях окрасок в пределах 10 – 15%.
.
Вопрос # 3 Сформулируйте закон Гесса и следствия из него
Закон Гесса —количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий).. Согласно закону Гесса, тепловые эффекты всех реакций связаны следующим соотношением:
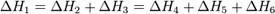
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа)
Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):

Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Вопрос 4 Адсорбция,физическая и химическая; Изотерма адсорбции Лангмюра.
Адсорбция — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза-жидкость, конденсированная фаза - газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз
На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция. Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P:
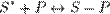 ;
;
уравнение равновесия в таком случае:
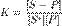 ,
,
где K — константа равновесия, [S − P] и [S*] — доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] — концентрация адсорбтива.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнениемЛенгмюра:
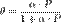 ,
,
где 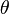 — доля площади поверхности адсорбента, занятая адсорбатом,
— доля площади поверхности адсорбента, занятая адсорбатом, 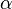 — адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
— адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
Поскольку 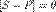 и, соответственно,
и, соответственно,  , уравнение адсорбционного равновесия может быть записано следующим образом:
, уравнение адсорбционного равновесия может быть записано следующим образом:
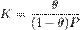 Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
Билет № 52
Вопрос 1.Формы осадков. Примеры
Процесс образования осадка протекает в несколько стадий. Вначале образуются центры кристаллизации, первичные кристаллы. Затем эти первичные кристаллы или их небольшие агрегаты соединяются в значительно более крупные частицы и выпадают в осадок. Эта последняя стадия может проходить разными путями, в зависимости от которых получается тот или иной твид осадка.Различают 2 формы осадка: осаждаемая и гравиметрическая. Осадок полученный действием осадителя называют осаждаемой формой. Осадок полученный после термической обработки для взвешивания называют гравиметрической формой. Mgв степени 2+ +С2О4 в степени 2- ==== MgO+CO↑+CO2↑
↓ ↓
Осаждаемаяформа гравиметр.форма
Вопрос 2 Аналитический сигнал рефрактометрии и прибор его определение
Показа́тель преломле́ния вещества — величина, равная отношению фазовых скоростей света (электромагнитных волн) в вакууме и в данной среде 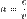 . Также о показателе преломления говорят для любых других волн, например, звуковых Показатель преломления - аналитический сигнал в рефрактометрии. Для измерения показателя преломления используют ручные и автоматические рефрактометры.
. Также о показателе преломления говорят для любых других волн, например, звуковых Показатель преломления - аналитический сигнал в рефрактометрии. Для измерения показателя преломления используют ручные и автоматические рефрактометры.
Отношение показателя преломления одной среды 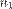 к показателю преломления второй
к показателю преломления второй 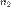 называют относительным показателем преломления
называют относительным показателем преломления 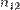 первой среды по отношению к второй. Для
первой среды по отношению к второй. Для 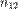 выполняется:
выполняется: 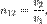 где
где  и
и  — фазовые скорости света в первой и второй средах соответственно. Очевидно, что относительным показателем преломления
— фазовые скорости света в первой и второй средах соответственно. Очевидно, что относительным показателем преломления 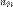 второй среды по отношению к первой является величина, равная
второй среды по отношению к первой является величина, равная 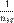 .
.
Рефрактометр – это оптический инструмент, предназначенный для измерения концентрации растворов с помощью явления преломления света. Термин «рефракция» (от лат. refractus - преломленный и греч. metreo - измеряю) был введен в науку Ньютоном в начале 18-го века.
Принцип действия рефрактометра базируется на использовании явления преломления света. При переходе из одного вещества в другое луч света отклоняется от прямолинейного направления на некоторый угол. Соотношение угла вхождения луча света в вещество и угла преломления его на границе раздела двух сред называется коэффициентом (показателем) преломления. Основным оптическим элементом рефрактометра является главная призма, на которую наносится исследуемое вещество. Главная призма состоит из материала с высоким показателем преломления.
Благодаря этому, падающий свет, проходя через вещество и призму, преломляется под достаточно большим углом. Далее, через систему оптических линз, свет попадает на шкалу рефрактометра (проградуированную окружность). В зависимости от угла преломления луч света оказывается выше или ниже на шкале прибора. Освещенная часть шкалы при этом будет светлой; та часть, на которую луч света не попадет окажется темной. Величина угла преломления света зависит от состава раствора и его концентрации. Таким образом, по положению границы раздела между светом и тенью можно однозначно определить коэффициент преломления или оптическую плотность исследуемого раствора.
Вопрос 3 Аналитическое выражение второго закона термодинамики
В качестве основной формулировки можно принять постулат Клаузиуса по которому: теплота самопроизвольна не может переходить от холодного тела к горячему. Переход тела возможен только от горячего тела к холодному и этот процесс идет в определенном направлении до тех пор, пока не наступит состояние равновесия. Всякий самопроизвольно идущий процесс в конечном итоге приводит систему к равновесию. Различают обратимые и необратимые хим. Реакции. Обратимые реакции начинают идти в одном направлении, а затем в результате взаимодействия продуктов реакции протекает и обратимый процесс. Все реакции являются обратимыми, анеобратимость связанна со смещением равновесия, например, вследствие удаления из сферы реакции одного из продуктов. Например: 2H2O+O2=2H2O при низких температурах идет в прямом направлении и равновесие наступает при очень малых концентрациях водорода и кислорода; при высоких температурах самопроизвольно идет обратная реакция-разложение воды на водород и кислород.
Вопрос 4 Оптические свойства и методы исследования дисперсных систем
Оптические свойства дисперсных систем обусловлены взаимодействием электромагнитного излучения, обладающего определенной энергией, с частицами дисперсной фазы. Особенности оптических свойств дисперсных систем определяются природой частиц, их размерами, соотношением между длиной волны электромагнитного излучения и размерами частиц. Одним из характерных оптических свойств является рассеяние света.
В зависимости от свойств частиц дисперсной фазы и их размеров свет, проходя через дисперсную систему, может поглощаться, отражаться или рассеиваться.Дисперсные системы способны к рассеянию света. В результате рассеяния проходящий через коллоидный раствор луч света становится видимым Этот вид рассеяния называется опалесценцией (в молекулярных и ионных растворах этот эффект не наблюдается).Способностью к светорассеянию обладают не только частицы, но и ассоциаты молекул, макромолекулы, включения, нарушающие однородность среды. Рассеяние заключается в преобразовании веществом света, которое сопровождается изменением направления света. УЛЬТРАМИКРОСКОПИЯ оптич. метод наблюдения и анализа коллоидных частиц в жидкой или газовой фазе с помощью ультрамикроскопов (УМ). Разработан и реализован P. Зигмонди и Г. Зидентопфом (1903) В основе ультрамикроскопии лежит дифракция света на коллоидных частицах, размер к-рых меньше половины длины световой волны, в результате чего система начинает светиться. Яркость свечения, а следовательно, и видимость частиц зависят от разности показателей преломления частицы идисперсионной среды. Если она велика то отчетливо фиксируются частицы размерами 2-4 нм, то обнаруживаются только частицы размерами не менее 20-40 нм.
Нефелометрия метод исследования и анализа вещества по интенсивности светового потока, рассеиваемого взвешенными частицами данного вещества.Интенсивность рассеянного светового потока зависит от множества факторов, в частности от концентрации частиц в анализируемой пробе. Большое значение при нефелометрии имеет объём частиц, рассеивающих свет. Важное требование к реакциям, применяемым при нефелометрии, заключается в том, что продукт реакции должен быть практически нерастворим и представлять собой суспензию (взвесь). Для удержания твёрдых частиц во взвешенном состоянии применяются различные стабилизаторы (например, желатин), предотвращающие коагуляцию частиц.Для измерения интенсивности рассеянного света используются специальные приборы — нефелометры. Их действие основано на уравнивании двух световых потоков: одного от рассеивающей взвеси, другого от матового или молочного стеклянного рассеивателя прибора. Нефелометрия используется преимущественно для определения хлоридов (в виде взвеси AgCl), сульфатов (в виде взвеси BaSO4) при анализе различных материалов, например руд, минералов. Нефелометрию также применяют для определения размеров и формы диспергированных частиц, молекулярной массы полимеров, изучения коагуляции.
Билет 53
Вопрос 1 Структура осадков. Примеры.
По структуре различают: кристаллические и аморфные осадки.
. ^ Аморфный осадок. Быстрое прибавление осадителя к концентрированному раствору вызывает образование мелких агрегатов, которые соединяются в более крупные объемистые частицы, слабо связанные между собой. Существенной характеристикой аморфного осадка является большая общая поверхность. В связи с этим на поверхности аморфного осадка происходит адсорбция посторонних веществ. Аморфный осадок образуют многие сульфиды металлов, гидроксиды металлов, кремниевая кислота и др. Аморфные осадки отделяют сразу после осаждения..
Кристаллический осадок. Постепенное медленное прибавление осадителя к разбавленному раствору вызывает образование новых центров кристаллизации. Вещество некоторое время остается в пересыщенном растворе. При постепенном добавлении осадителя происходит рост образовавшихся ранее кристаллических центров. В результате образуется кристаллический осадок, состоящий из крупных кристаллов. Кристаллические осадки требуют времени для созревания от 30 мин. до суток в зависимости от природы вещества. Например, BaSO4 - кристаллический осадок. С кристаллическими осадками работать удобнее, чем с аморфными. Пример: 2 FeCl3 + 6 NH4OH=== 2 Fe(OH)3↓+ 6 NH4Cl====при температуре===4 Fe2O3 + 6 NH4Cl+3H2O
↓
Аморфный коричневый осадок
BaCl2*2H2O+H2SO4===BaSO4↓==при температ==BaSO4
↓
Белый крист. Осадок
Вопрос2 Удельная и эквивалентная электропроводности и их взаимосвязь
Электропроводность раствора электролита характеризуется его способностью проводить электрический ток. Она является величиной обратной электрическому сопративлению. Различают удельную и эквивалентную электропроводность. Удельной электропроводностью ϰ назвается электропроводность раствора электролита, заключенного между электродами площадью 1 см в квадрате, каждый расположенный на расстоянии 1 см друг от друга. Удельная электропроводность измеряется в См/см(сименс на сантиметр) Эквивалентно электропроводностью λ называется электропроводность раствора, содержащего один эквивалент вещества и заключенного между электродами, расположенными на расстоянии 1 см. Единица эквивалентной электропроводности См*см в квадрате / моль экв. Между эквивалентной и удельной электропроводимостью существуют следующая зависимость: λ=1000ϰ/с. С-это эквивалентная концентрация раствора электролита, выраженная в моль экв/л.
Вопрос 3 Энтропия и термодинамическая вероятность. Уравнение Больцмана.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. энтропия определяется как функция состояния системы, равная в равновесном процессе количеству теплоты, сообщённой системе или отведённой от системы, отнесённому к термодинамической температуре системы:
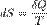 , где
, где 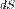 — приращение энтропии;
— приращение энтропии; 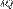 — минимальная теплота, подведённая к системе;
— минимальная теплота, подведённая к системе; 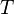 — абсолютная температура процесса.
— абсолютная температура процесса.
Вероятность термодинамическая — число способов, которыми может быть реализовано данное состояние макроскопической физической системы. В термодинамике состояние физической системы характеризуется определёнными значениями плотности, давления, температуры и др. измеряемых величин. Каждое состояние физической системы с определённым распределением её частиц по возможным классическим или квантовым состояниям называют микросостоянием.Вероятность термодинамическая W равна числу микросостояний, реализующих данное макросостояние, из чего следует, что W ≥1.Её легко вычислить лишь в случае идеальных газов. Для реальных систем вероятность термодинамическую можно оценить по величине статистической суммы. Вероятность термодинамическая связана с энтропией S системы соотношением Больцмана:S = k ln W.
Вопрос 4 Физико-химические свойства растворов ВМС. Набухание. Высаливание. Коацервация
Растворы высокомолекулярных соединений – термодинамически устойчивые системы.. Следовательно, нарушить устойчивость растворов полимеров возможно или уменьшением количества “свободного” растворителя или уменьшением энтропийного фактора. Первое достигается добавлением к раствору ВМС десольватирующих веществ, например, добавлением к водному раствору полимера – электролита. Понижение энтропийного фактора возможно за счет образования межмолекулярных связей, например, при увеличении концентрации полимера в растворе.
Высаливание.Процесс выделения ВМС из раствора при добавлении в раствор десольватирующих веществ (электролитов или неэлектролитов) называется высаливанием. Высаливание из водного раствора полимера происходит при добавлении относительно больших количеств электролита, не подчиняется правилу Шульце-Гарди и является вполне обратимым процессом – при добавлении избытка растворителя или после удаления из системы электролита (промыванием или диализом) высокомолекулярное вещество снова растворяется.
Высаливание полимера путем добавления неэлектролитов принципиально не отличается от выделения ВМС\
из раствора электролитом. Обычно это жидкость, которая растворяет полимер хуже, чем растворитель. Например, для белка – это спирт, а для каучука – ацетон.
Коацервация.При нарушении устойчивости раствора белка или полисахарида возможно образование коацервата – новой жидкой фазы, обогащенной биополимером. Коацерват может выделяться в виде капель или образовывать сплошной слой, что приводит к расслаиванию системы на две фазы. Одна из фаз представляет собой раствор ВМС в растворителе, а другая – раствор растворителя в высокомолекулярном веществе. Коацервацию можно вызвать изменением температуры, pH среды или введением низкомолекулярных веществ.Коацервацию используют при микрокапсулировании лекарственных веществ. Набухание заключается в следующем: молекулы низкомолекулярной жидкости-растворителя проникают в погруженное в нее ВМС, заполняя свободные пространства между макромолекулами. Это вполне возможно, так как цепочки макромолекул «упакованы» неплотно. Проникнув вначале благодаря капиллярным силам, растворитель дальше начинает поступать внутрь набухающего тела уже в нарастающем количестве благодаря гидратации полярных групп указанных соединений. Основное значение гидратации заключается в ослаблении межмолекулярных связей, разрыхлении этих соединений. Образующиеся просветы заполняются новыми молекулами растворителя. Раздвиганию звеньев и цепей макромолекул способствуют и осмотические явления, протекающие одновременно с гидратацией полярных групп высокомолекулярных соединений.После того как будут разрушены связи между макромолекулами, т. е. когда нити их будут достаточно отодвинуты друг от друга, макромолекулы, получив способность к тепловому движению, начинают медленно диффундировать в фазу растворителя. Набухание переходит в растворение.Процесс набухания указанных соединений нужно рассматривать как протекающий в две стадии. Первая стадия (сольватация - гидратация) сопровождается выделением тепла, т. е. убылью свободной энергии, и объемным сжатием Во второй стадии набухания жидкость поглощается без выделения тепла В этой стадии происходит поглощение большого количества растворителя, а в связи с этим и весьма значительное (в 10-15 раз) увеличение объема набухающего ВМС.Набухание такого соединения не всегда заканчивается его растворением. Набухание может быть неограниченным и ограниченным. Неограниченное набухание заканчивается растворением: соединение сначала поглощает растворитель, а затем при той же температуре переходит в раствор. При ограниченном набухании высокомолекулярное соединение поглощает растворитель, а само в ней не растворяется, сколько бы времени оно ни находилось в контакте. Ограниченное набухание такого соединения всегда заканчивается образованием эластического геля (студня).Набухание высокомолекулярных соединений носит избирательный характер. Они набухают лишь в жидкостях, которые близки им по химическому строению. Так, указанные соединения, имеющие полярные группы, набухают в полярных растворителях, а углеводородные - только в неполярных жидкостях (бензин, бензол и т. п.).
Билет
1)Под соосаждением понимают выпадение в осадок соединений, произведение растворимости которых еще не достигнуто, поэтому в отсутствие других осадков они не осаждаются.По механизму захвата посторонних веществ различают несколько видов соосаждения: адсорбцию, окклюзию, образование твердого раствора (изоморфизм). Адсорбцией называется взаимодействие вещества с поверхностью твердого тела (адсорбента). Окклюзия – вид соосаждения, при котором происходит захват примесей из раствора внутрь кристалла. Изоморфизм –свойство ионов замещать друг друга в кристалле с образованием фаз переменного состава: смешанных кристаллов или твердых растворов.
2) КУЛОНОМЕТРИЯ — электрохимический метод исследования и анализа веществ, основанный на измерении количества электричества, расходуемого на электролитическое восстановление или окисление вещества. В основу кулонометрии положен закон Фарадея. Законы Фарадея- основные законы электролиза.Устанавливают взаимосвязь между количеством электричества, проходящего через электропроводящий раствор (электролит), и количеством вещества, выделяющегося на электродах.Первый закон ФАРАДЕЯ: масса вещества m, выделяющегося на электроде, при прохождении электрического тока прямо пропорциональна значению q электрического заряда, пропущенного через электролит: m = kq, где k – электрохимический эквивалент вещества, численно равный массе вещества, выделившегося при прохождении через электролит единицы количества электричества. При пропускании через электролит постоянного тока I в течение секунды q = It, m = kIt. Второй закон ФАРАДЕЯ: электрохимические эквиваленты элементов прямо пропорциональны их химическим эквивалентам. Отношение атомного веса A элемента к его валентности z называется химическим эквивалентом;количество вещества, масса которого, выраженная в граммах, равна его химическому эквиваленту, называется грамм-эквивалентом;величина, обратная C, называется числом Фарадея.Число Фарадея равно количеству электричества, которое нужно пропустить через электролит для выделения на электроде одного грамм-эквивалента любого вещества.
3) Тепловым эффектом называется количество выделенной или поглощенной теплоты при следующих условиях: система совершает только работу расширения, объем или давление остаются постоянными, температуры исходных и конечных веществ одинаковы, реакция протекает практически до конца.Для расчета тепловых эффектов различных процессов, (в том числе и состоящих из нескольких этапов) в термодинамике применяют закона Гесса (установлен экспериментально Г.И. Гессом), который формулируется следующим образом: «Тепловой эффект химической реакции не зависит от пути процесса, а определяется лишь состоянием исходных и конечных веществ, в ней участвующих». Тепловой эффект химической реакции равен разности сумм произведений энтальпий образования конечных и исходных веществ на стехиометрические коэффициенты в уравнении реакции. Тепловой эффект процесса зависит от температуры. Эта зависимость определяется законом Кирхгофа, который формулируется следующим образом: «Частная производная от теплового эффекта по температуре равна разности теплоемкости системы в конечном и исходном состояниях»
4) Дисперсные системы, гетерогенные системы из двух или большего числа фаз с сильно развитой поверхностъю раздела между ними. Обычно одна из фаз образует непрерывную дисперсионную среду, в объеме которой распределена дисперсная фаза (или несколько дисперсных фаз) в виде мелких кристаллов. твердых аморфных частиц, капель или пузырьков. Дисперсные системы могут иметь и более сложное строение, например, представлять собой двухфазное образование, каждая из фаз которого, будучи непрерывной, проникает в объем другой фазы. К таким системам относятся твердые тела. пронизанные разветвленной системой каналов-пор, заполненных газом или жидкостью. некоторые микрогетерогенные полимерные композиции и др. Нередки случаи, когда дисперсионная среда "вырождается" до тончайших слоев (пленок), разделяющих частицы дисперсной фазы
Билет
1) Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях.
Эквивалентное соотношение означает одинаковое число моль эквивалентов. Т.о. закон эквивалентов можно сформулировать иначе: число моль эквивалентов для всех веществ, участвующих в реакции, одинаково. Точка эквивалентности (в титриметрическом анализе) — момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце. В некоторых случаях наблюдают несколько точек эквивалентности, следующих одна за другой, например, при титровании многоосновных кислот или же при титровании раствора, в котором присутствует несколько определяемых ионов.
Вопрос 2) ХРОМАТОГРАФИЯ-метод разделения, анализа и физ.-хим. исследования в-в. Обычно основана на распределении исследуемого в-ва между двумя фазами - неподвижной и подвижной (элюент). Неподвижная фаза гл. обр. представляет собой сорбент с развитой пов-стью, а подвижная - поток газа (пара, флюида -в-во в сверхкритич. состоянии) или жидкости. Поток подвижной фазы фильтруется через слой сорбента или перемещается вдоль слоя сорбента. Существуют различные способы классификации хроматографических методов. 1.По физической природе неподвижной и подвижной фаз. Жидкостная хроматография ЖХ (если подвижная фаза жидкая) и газовая хроматография. 2. В зависимости от способа перемещения сорбатов вдоль слоя сорбента различают проявителъный (элюентный), фронтальный, вытеснителъный методы и электрохроматографию. 3. В зависимости от природы процесса, обусловливающего распределение сорбатов между подвижной и неподвижной фазами, различают адсорбционную, распределительную, ионообменную, осадочную, аффинную и эксклюзи-онную хроматографию. 4. По технике выполнения (характеру процесса) различают: колоночную хроматографию (неподвижная фаза находится в колонке); плоскостную (планарную) — бумажную и тонкослойную (неподвижная фаза — лист бумаги или тонкий слой сорбента на стеклянной или металлической пластинке); капиллярную хроматографию (разделение происходит в пленке жидкости или слое сорбента, размещенном на внутренней стенке трубки); хроматографию в полях (электрических, магнитных, центробежных и других сил).
5. В зависимости от цели проведения хроматографичес-кого процесса различают аналитическую, неаналитическую, препаративную и промышленную хроматографию.
Вопрос 3) Трехкомпонентые системы-это позволяет применить для выражения состава плоскую диаграмму, напримертреугольную диаграмму Гиббса — Розебома или плоскую систему прямоугольных координат. В таких случаях величину свойства — температуру или давление можно откладывать по ординате — перпендикуляру к плоскости треугольника. Так как по ординате можно наносить значения только одного свойства, мы вынуждены делать дополнительные упрощения — при построении диаграммы выбирать некоторое постоянное давление или постоянную температуру. Обычно в качествепостоянной величины принимается давление, подобно тому, как это было принято при построении плоскостных диаграмм двухкомпонентных систем. Однако при наличии трех компонентов диаграмма, выражающая зависимость состава и температуры, оказывается уже диаграммой не плоской, а объемной. На рис. 71 изображена простейшая объемная диаграмма трехкомпонентной системы,компоненты которой не образуют химических соединений, неограниченно растворяются друг в друге в жидком состоянии и не растворяются в твердом состоянии. Каждая из граней такой концентрационной призмы представляет собойплоскую диаграмму состояния двухкомпонентной системы. Любая точка внутрипризмы соответствует трехкомпонентным растворам при различных температурах
4) Коагуляция - это самопроизвольный физический процесс укрупнения частиц дисперсной фазы в результате потери агрегативной устойчивости под влиянием внешних факторов. высокой концентрации частиц в системе такой слой образует четкую границу (структурная седиментация). Кроме того, коагуляция приводит к увеличению конечного объема осадка. Правило Шульце - Гарди:
"Коагулирующий ион имеет заряд, протиоположный коллоидной частицы, и чем он больше, тем больше его коагулирующее действие."
Билет 56
КОАГУЛЯЦИЯ (от лат. coagulatio- свертывание, сгущение), объединение частиц дисперсной фазы в агрегаты вследствие сцепления (адгезии) частиц при их соударениях. Соударения происходят в результате броуновского движения, а также седиментации, перемещения частиц в электрич. поле (электрокоагуляция), мех. воздействия на систему (перемешивания, вибрации) и др. Характерные признаки коагуляции - увеличение мутности (интенсивности рассеиваемого света), появление хлопьевидных образований - флокул (отсюда термин флокуляция, часто используемый как синоним коагуляции), расслоение исходно устойчивой к седиментации системы (золя) с выделением дисперсной фазы в виде коагулята (осадка, сливок). Пептизация — расщепление агрегатов, возникших при коагуляции дисперсных систем, на первичные частицы под действием жидкой среды (например, воды) или специальных веществ — пептизаторов. Пептизация — один из способов получения коллоидных растворов, применяется в технике при получении высокодисперсныхсуспензий глин и других веществ.
Вопрос 2) Рефрактометрия (от лат. refractus - преломленный и греч. metreo - измеряю) - это метод исследования веществ, основанный на определении показателя (коэффициента) преломления (рефракции) и некоторых его функций. Рефрактометрия (рефрактометрический метод) применяется для идентификации химических соединений, количественного и структурного анализа, определения физико-химических параметров веществ.
Вопрос 3) Уде́льная теплоёмкость — отношение теплоёмкости к массе, теплоёмкость единичной массы вещества (разная для различных веществ); физическая величина, численно равная количеству теплоты, которое необходимо передать единичной массе данного вещества для того, чтобы его температура изменилась на единицу. Молярная теплоёмкость — отношение теплоёмкости к количеству вещества, теплоёмкость одного моль вещества (в принципе разная для различных веществ, хотя в свете закона Дюлонга — Пти - имеет близкое значение, и даже приближенно совпадает в достаточно широких пределах изменения температуры у многих веществ).Это физическая величина, численно равная количеству теплоты, которое необходимо передать одному молю (данного) вещества для того, чтобы его температураизменилась на единицу. Истинная теплоемкость представляет собой отношение количества теплоты (dQ), полученной веществом при бесконечно малом изменении его состояния, к изменению температуры тела (dT) в данном процессе
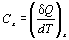 , Дж/К.
, Дж/К.
Средняя теплоемкость -количество теплоты, которое необходимо для нагревания на 1° единицы количества газа, называется теплоемкостью и обозначается буквой с. Средняя теплоемкость определяет среднее количество подведенной теплоты при нагревании единицы количества газа на 1° в интервале температур от tx до t%: где q - количество теплоты, подведенной к единице массы газа при его нагревании от температуры tt до температуры t%
Вопрос 4) Мицелла (уменьшительное от лат. mica — частица, крупинка) — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкойадсорбированных ионов и молекул растворителя. Например, мицелла сульфида мышьяка имеет строение:
{(As2S3)m•nHS−•(n-x)H+}x-•хН+
Средний размер мицелл от 10−5 до 10−7
К мицеллам относят также частицы в растворах поверхностно-активных веществ (ПАВ), называемых лиофильными коллоидами
Билет 57
1.Аналитический сигнал гравиметрии.
2.Оптическая плотность: формула, смысл, факторы влияющие на величенуА.
3. Диаграмма состояния воды.
4. Поверхностная активность.Правило Траубе-Дюкло.
1. АНАЛИТИЧЕСКИЙ СИГНАЛ
После отбора и подготовки пробы наступает стадия химического анализа, на которой и проводят обнаружение компонента или определение его количества. С этой целью измеряют аналитический сигнал. В большинстве методов аналитическим сигналом является среднее из измерений физической величины на заключительной стадии анализа, функционально связанной с содержанием определяемого компонента.
В случае необходимости обнаружения какого-либо компонента обычно фиксируют появление аналитического сигнала – появление осадка, окраски, линии в спектре и т.д. Появление аналитического сигнала должно быть надежно зафиксировано. При определении количества компонента измеряется величина аналитического сигнала – масса осадка, сила тока, интенсивность линии спектра и т.д.
Вопрос 2. Оптическая плотность: формула, смысл, факторы влияющие на величину 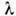 ОПТИЧЕСКАЯ ПЛОТНОСТЬ (D) - мера непрозрачности слоя вещества толщиной l для световых лучей; характеризует ослабление оптич. излучения в слоях разл. веществ (красителях, светофильтрах, растворах, газах и т. п.). Для неотражающего слоя D = lgI0/I =
ОПТИЧЕСКАЯ ПЛОТНОСТЬ (D) - мера непрозрачности слоя вещества толщиной l для световых лучей; характеризует ослабление оптич. излучения в слоях разл. веществ (красителях, светофильтрах, растворах, газах и т. п.). Для неотражающего слоя D = lgI0/I = 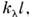 где I - интенсивность излучения, прошедшего поглощающую среду; I0 - интенсивность излучения, падающего на поглощающую среду;
где I - интенсивность излучения, прошедшего поглощающую среду; I0 - интенсивность излучения, падающего на поглощающую среду; 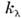 - поглощения показатель среды для излучения с длиной волны
- поглощения показатель среды для излучения с длиной волны 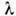 , связанный с уд. показателем поглощения
, связанный с уд. показателем поглощения 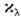 в Бугера - Ламберта - Бера законе соотношением
в Бугера - Ламберта - Бера законе соотношением 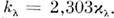 О. п. может быть определена и как логарифм величины, обратной пропускания коэффициенту
О. п. может быть определена и как логарифм величины, обратной пропускания коэффициенту 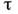 слоя вещества:
слоя вещества: 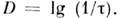 Введение О. п. удобно при вычислениях, т. к. она меняется на неск. единиц, тогда как величина I0/I может для разл. образцов и на разл. участках спектра изменяться на неск. порядков. О. п. смеси нереагирующих друг с другом веществ равна сумме О. п. отд. компонентов.
Введение О. п. удобно при вычислениях, т. к. она меняется на неск. единиц, тогда как величина I0/I может для разл. образцов и на разл. участках спектра изменяться на неск. порядков. О. п. смеси нереагирующих друг с другом веществ равна сумме О. п. отд. компонентов.
Вопрос 3. диаграмма состояния воды
диаграмма равновесия, фазовая диаграмма, - графич. изображение равновесных состояний (см. Равновесие термодинамическое) в-ва в виде точек в n-мерном пространстве, по осям координат к-рого отложены п независимых параметров состояния рассматриваемой системы. Напр., в простейшем случае однокомпонентной системы n=2 и Д. с. можно изобразить в прямоугольной системе координат на плоскости. В технич. термодинамике и теплотехнике наиболее употребительны Д. с. v - р (уд. объём - давление), Т - р (термодинамич. темп-pa - давление), s - Т (уд. энтропия - термодинамич. темп-ра) b s - h (уд. энтропия - уд. энтальпия). На Д. с. однокомпонентной системы в координатах Т - р, показанной на рис., однофазным равновесным состояниям (см. Фаза) соответствуют части плоскости, огранич. осями координат и кривыми, к-рые характеризуют двухфазные состояния. Д. с. двухкомпонентной системы трёхмерна (п = 3). Обычно она строится в координатах Т, р, с(массовая или молярная доля одного из компонентов). Часто под Д. с. двухкомпонентной системы понимают сечение её трехмерной Д. с. плоскостью р = 101,325 кПа.
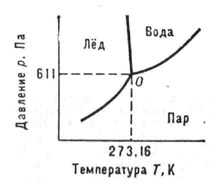
Диаграмма состояния воды (О - тройная точка, в которой система состоит из льда, воды и пара, находящихся в ранновесии)
Вопрос 4.Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 раза.Поверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ2-группу. Правило было сформулировано И.Траубе в 1891 году в результате его опытов, проведённых на растворах множества веществ (карбоновые кислоты, эфиры, спирты, кетоны) в воде. Предшествующие исследования Э.Дюкло хотя и были близки по духу к работам Траубе, но не предлагали никакой ясной зависимости концентрации, поэтому в зарубежной литературе правило носит лишь имя Траубе. Термодинамическую интерпретацию правила Траубе дал в 1917году И.Ленгмюр
Билет 58
Объемно – измерительная посуда титриметрии и их назначение.
Уравнение Ленгмюра. (изотерма адсорбции).
3. Диаграмма состояния с простой эвтектикой.
4. Системы с газообразной дисперсионной средой. Аэрозоли. Порошки.
1. Посуда в титриметрическом анализе и техника работы с ней
Точность измерения объемов является одним из основных положений, определяющяя правильность титриметрического анализа. Из измерительной посуды наиболее употребительны бюретки, пипетки, мерные колбы и цилиндры. Мерная посуда и техника работы с ней представлены на рисунках.
Мерные колбы. Они представляют собой плоскодонные колбы с длинным узким горлышком, на котором нанесена круговая метка. На колбе обозначены ее объем и температура, при которой измерялась вместимость колбы. Мерные колбы служат для приготовления титрованных растворов по точной навеске или разбавлением более концентрированных растворов, а также для разбавления анализируемого вещества до определенного объема. Они выпускаются на 50, 100, 200, 250, 500, 1000 и 2000 мл. Мерные колбы изготавливают из химически и термически нестойкого стекла, поэтому в них нельзя хранить растворы в течение продолжительного времени или проводить какие-либо реакции, а также нагревать, иначе может произойти деформация стекла, что вызовет изменение их объема. Закрывают колбы специальными притертыми пробками. При приготовлении растворов навеску вещества или точно измеренный объем более концентрированного раствора необходимо количественно перенести через воронку в колбу, ополоснуть воронку дистиллированной водой, растворить вещество, помешивая содержимое колбы вращательным движением и довести объем раствора до круговой метки. При этом колбу надо держать так, чтобы метка находилась на уровне глаз.
Бюретки. Они служат для титрования или точного измерения небольших объемов и представляют собой цилиндрические трубки с суженным концом, который снабжен специальным краном, или соединен резиновой трубкой с оттянутым стеклянным капилляром. Резиновую трубку закрепляют металлическим зажимом или вставляют стеклянную «бусинку» или оплавленный кусочек (7-8мм) стеклянной палочки по толщине больше диаметра резиновой трубки, в противном случае бюретка будет «подтекать». По вместимости бюретки бывают разные: от 5,10 (микробюретки) до 50, 100 мл. Их калибруют в миллилитрах и их десятых долях (0,1 мл). Нулевое положение находится в верхней части бюретки.
Если бюретка с наконечником (капилляром), то для удаления пузырьков воздуха наконечник поднимают под небольшим углом и, оттянув резиновую трубку в месте шарика или слегка открыв зажим выгоняют воздушные пузырьки сливаемым раствором.
При пользовании бюреткой необходимо выполнять следующие правила:
работать только с чистой бюреткой;
укреплять бюретку в штативе строго вертикально;
перед каждым титрованием заполнять бюретку раствором до нулевого деления;
при всех отсчетах по бюретке глаз наблюдателя должен находиться строго на уровне мениска;
при титровании жидкость из бюретки выпускать очень медленно;
при измерении объемов окрашенных темных растворов отсчет следует вести по верхнему мениску, а бесцветных - по нижнему мениску. Важно, чтобы в каждой работе все отсчеты были выполнены одинаково.
Пипетки. Применяют для точного отмеривания определенного объема (аликвотный) раствора и перенесения его из одного сосуда в другой, например, из мерной колбы в коническую колбу для титрования или в другую мерную колбу для разбавления. Они бывают двух типов: градуированные (измерительные) и мерные, которые, как правило, применяют в титриметрии. Пипетки могут быть различной емкости: 1, 2, 5, 10, 15, 20, 25, 50 и 100 мл. Мерные пипетки представляют собой узкие трубки с расширением в середине. В верхней узкой части находится круговая отметка.
Перед употреблением чистые пипетки дважды ополаскивают раствором, которым будут ее наполнять. Для взятия жидкости пипеткой ее берут за верхнюю часть большим, средним и указательным пальцами правой руки (рис.21), погружают глубоко в раствор и засасывают его на 1-2 см выше кольцевой отметки. Указательным пальцем закрывают верхнюю часть пипетки и осторожно, ослабив этот палец, доводят раствор до метки, при этом пипетку держать так, чтобы метка находилась на уровне глаза. Затем, плотно закрыв отверстие указательным пальцем, переносят раствор в сосуд (чаще всего в колбу для титрования). Держа пипетку вертикально, отнимают от ее отверстия палец и дают жидкости свободно вытекать; когда вся жидкость вытечет, прикасаются кончиком пипетки к стенке сосуда и ждут 20 с, не обращая внимание на небольшое количество раствора оставшегося в ее носике.
Ни в коем случае не следует выдувать или вытряхивать последние капли жидкости из пипетки, это может повлиять на результаты титрования.
Мерные цилиндры и мензурки. Их используют только для приблизительного отмеривания растворов вспомогательных реактивов, объемы которых не учитывают при вычислении.
Колбы для титрования. Они представляют собой сосуды конической формы с суженным горлом. Чаще всего применяют колбы емкостью 100,200 и 500 мл.
Вопрос 2. уравнение Ленгмюра
По модели Ленгмюра все атомы поверхности имеют энергетически одинаковые адсорбционные центры, т.е. рассматривается однородная поверхность. На одном центре адсорбируется одна молекула адсорбата и при заполнении всех центров образуется один монослой. Взаимодействием между соседними адсорбированными молекулами в теории пренебрегают. При адсорбционном равновесии скорость адсорбции равна скорости десорбции. Скорость адсорбции пропорциональна парциальному давлению р (или концентрации с) адсорбирующегося вещества и доле свободной поверхности (1-θ), а скорость десорбции пропорциональна только доле (от монослоя) заполнения поверхности θ. Уравнение Ленгмюра a = a bp/(1 + bp) или a = abc/(1 + bc), где b = k/k = K -1 – адсорбционный коэффициент. k - константа скорости адсорбции, k - константа скорости десорбции. При выводе изотермы адсорбции Ленгмюр не разделял физическую и химическую адсорбции. В действительности изотерма Ленгмюра применялась, скорее, для химической адсорбции.
Вопрос 3. Диаграмма состояния с простой эвтектикой
Однокомпонентной системой является любое простое вещество или химическое соединение, обладающее строго определенным составом в газообразном, жидком и твердом состояниях. Диаграмму состояния обычно строят на плоскости в координатах T-p (рис. 1). Фазовые поля (области существования) пара V, жидкости L и твердой фазы S дивариантны, т.е. допускают одновременное изменение двух параметров состояния - Т и р.

Рис. 1. Диаграмма состояния однокомпонентной системы. S, L и V - соответственно области существования твердой, жидкой и паровой фаз; 1, 2 и 3 - кривые кипения (испарения), плавления и возгонки (сублимации) соответственно, К - критическая точка; А - тройная точка.
Двухфазное равновесие между жидкостью и паром изображается кривой кипения (или испарения) 1, между жидкостью и кристаллами - кривой плавления 2, между кристаллами и паром - кривой возгонки (или сублимации) 3. Все двухфазные равновесия моновариантны, т.е. не нарушаются при произвольном изменении только одного из параметров, Т или р; при этом значение другого определяется из диаграммы состояния. Кривая кипения 1 характеризует зависимость давления насыщенного пара вещества от температуры или зависимость температуры кипения вещества от внешнего давления. Со стороны повышенных T и р эта кривая заканчивается в критической точке К, где исчезает различие в свойствах между жидкостью и ее паром (подробнее см. ст. Критическое состояние). Жидкость может находиться в переохлажденном состоянии (пунктирная линия на рис. 1). Аналогично кривая плавления характеризует зависимость температуры плавления от внешнего давления, кривая возгонки - температурную зависимость давления насыщенного пара над твердым веществом. На рис. 1 ход кривой плавления соответствует повышению температуры плавления с ростом давления, однако возможно и понижение температуры плавления с давлением (см. Клапейрона - Клаузиуса уравнение). Все три кривые моновариантных фазовых равновесий сходятся в тройной точке А, отвечающей параметрам состояния, при которых находятся в нонвариантном равновесии три фазы. Диаграмма состояния усложняется, если вещество в твердом состоянии может существовать в различных кристаллических модификациях. Каждой модификации отвечает свое фазовое поле. Линии моновариантных равновесий, разграничивающие эти поля, называют кривыми превращений.
Вопрос 4. системы с газовой дисперсионной средой
Аэрозоли (туманы, пыль, дымы)
Отличие аэрозолей от лиозолей обусловлено прежде всего разреженностью (малой концентрацией частиц дисперсной фазы) и меньшей вязкостью дисперсионной среды.
В аэрозолях броуновское движение происходит гораздо более интенсивно, а седиментация частиц идет значительно быстрее, чем в лиозолях.
Другое существенное отличие заключается в том, что в газовой среде не происходит электролитическая диссоциация и, следовательно, невозможно образование двойного электрического слоя на поверхности коллоидной частицы, т.е. аэрозоли могут существовать без стабилизатора. Их устойчивость обусловлена редким столкновением частиц вследствие разреженности системы. Иногда на поверхности частиц, распределенных в газовой среде, по ряду причин могут возникать заряды, но эти заряды случайны и не определяют дисперсность системы и ее устойчивость.
Оптические свойства аэрозолей подчиняются тем же законам, что и оптические свойства лиозолей. Однако вследствие большой разности в плотности, а следовательно, и в показателях преломления обеих фаз, оптические свойства аэрозолей, прежде всего светорассеивание, проявляются ярче.
Для коллоидных систем с газовой дисперсионной средой характерны следующие особые свойства:
- термофорез – самопроизвольное удаление частиц аэрозоля от нагретых тел;
- термопреципитация – осаждение частиц аэрозоля на холодных участках неравномерно нагретой поверхности;
- фотофорез – явление передвижения частиц аэрозоля при одностороннем освещении.
Аэрозоли получают методами диспергирования и конденсации.
Для разрушения аэрозолей используют методы изменения скорости и направления потока (в циклонах), фильтрации, коагуляции, разрушения ультразвуком, электрическим полем высокого напряжения и др.
Порошки (аэрогели)
Порошки можно рассматривать как концентрированные аэрозоли с твердой дисперсной фазой. Размеры частиц порошков колеблются в широких пределах от 10-8 м (сажа) до 10-3 м (мука 3-его сорта). Дисперсность порошков оказывает очень сильное влияние на их свойства и практическое применение.
Основные свойствами порошков, имеющими большое значение при их практическом применении, является способность к течению и распылению.
Билет 59
1.Механизм образования осадков.
2.Уравнения Ильковича.
3. Катализ. Гомогенный катализ. Гетерогенный катализ.
4. Поверхностное натяжение. Поверхностная энергия Гиббса.
1. Механизм образования осадков
В процессе образования осадка различают три основных параллельно протекающих процесса: 1) образование зародышей кристаллов (центров кристаллизации); 2) рост кристаллов; 3) объединение (агрегация) хаотично ориентированных мелких кристаллов.
В начальный момент смешивания реагирующих компонентов раствор, содержащий эти компоненты, пересыщается (если произведение концентраций ионов реагирующих компонентов больше, чем произведение растворимости малорастворимого продукта их реакции) и образуются мельчайшие частицы осадка — зародыши. Зародыш кристалла — наименьший агрегат атомов, молекул или ионов, который образуется в виде твердой фазы при осаждении и способен к самопроизвольному росту. Образование зародышей в пересыщенном растворе может происходить как самопроизвольно, так и при введении в раствор твердых частиц осадка (или частиц другой природы), которые могут служить центром образования зародышей. Нерастворимые частицы, содержащиеся в реактивах и растворителе, также являются центром образования зародышей. Время с момента смешивания растворов реагирующих веществ до появления зародышей называют индукционным периодом, продолжительность его зависит от концентрации реагирующих веществ, а также от природы осадка. Так, при осаждении творожистого осадка хлорида серебра индукционный период незначителен, а при осаждении кристаллических осадков — достаточно велик.
Рост кристаллов происходит за счет диффузии ионов к поверхности растущего кристалла и осаждения этих ионов на его поверхности и определяется не только диффузионными процессами, но и Структурой растущих кристаллов, дефектами кристаллической решетки, внедрением в нее различных ионов и т. д.
Число и размер частиц осадка зависят от соотношения скорости образования зародышей кристаллов и скорости роста кристаллов. Если скорость образования зародышей кристаллов мала по сравнению со скоростью роста кристаллов, образуется небольшое число крупных частиц — осадок крупнокристаллический, при обратном соотношении скоростей получается мелкодисперсный осадок, состоящий из большого числа мелких частиц. Скорости обоих процессов зависят от относительного пересыщения раствора, которое определяется выражением
Относительное пересыщение= (С—S)/S, (П.1)
где С — концентрация осаждаемого вещества в растворе, получаемая в момент внесения осадителя; S — растворимость.
Вопрос 2. В полярографии предельный диффузионный ток (в мкА), усредненный по времени жизни капли, описывается уравнением Ильковича:
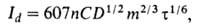
где n-число электронов, участвующих в электрохимической реакции, С-концентрация электроактивного вещества (мМ), D-eгo коэффициент диффузии (см2/с), 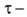 время жизни ртутной капли (с), m-скорость вытекания ртути (мг/с). Уравнение Ильковича отражает линейную зависимость величины предельного диффузионного тока от концентрации вещества в растворе, а также указывает на зависимость диффузионного тока от характеристики применяемого в эксперименте капающего электрода и характера электроактивных частиц.
время жизни ртутной капли (с), m-скорость вытекания ртути (мг/с). Уравнение Ильковича отражает линейную зависимость величины предельного диффузионного тока от концентрации вещества в растворе, а также указывает на зависимость диффузионного тока от характеристики применяемого в эксперименте капающего электрода и характера электроактивных частиц.
Вопрос 3. Катализ. Гомогенный катализ. Гетерогенный катализ.
Ката́лиз — избирательное ускорение одного из возможных термодинамически разрешенных направлений химической реакции под действием катализатора(ов), который многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
Диффузия реагирующих веществ к поверхности твердого вещества
Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их<
 2018-01-21
2018-01-21 2744
2744








