Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
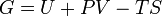
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Определение[
Классическим определением энергии Гиббса является выражение
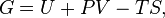
где 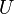 — внутренняя энергия,
— внутренняя энергия, 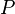 — давление,
— давление, 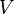 — объём,
— объём,  — абсолютная температура,
— абсолютная температура, 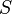 — энтропия.
— энтропия.
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление p и температуру T:
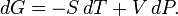
Для системы с переменным числом частиц этот дифференциал записывается так:
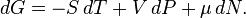
Здесь 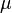 — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
— химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Связь с термодинамической устойчивостью системы
Покажем, что минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц.
Запишем обобщённое уравнение первого и второго начал термодинамики:
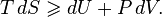
При 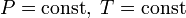 .
.
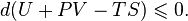
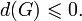
Таким образом в системе при постоянных температуре и давлении энергия Гиббса достигает минимального значения.
Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами.
Содержание
Определение
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
· 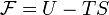 , где
, где 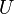 — внутренняя энергия,
— внутренняя энергия,  — абсолютная температура,
— абсолютная температура, 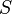 — энтропия.
— энтропия.
Отсюда дифференциал свободной энергии равен:
· 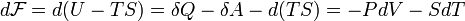 .
.
Видно, что это выражение является полным дифференциалом относительно независимых переменных  и
и 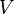 . Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию
. Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию 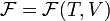 .
.
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
· 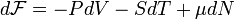 ,
,
где 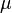 — химический потенциал, а
— химический потенциал, а 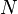 — число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция
— число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция 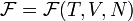 .
.
В соответствии с рекомендациями ИЮПАК энергию Гельмгольца в химической термодинамике можно также обозначать как A [1].
Свободная энергия Гельмгольца и устойчивость термодинамического равновесия
Можно показать, что в системе с фиксированными температурой и объемом положение устойчивого равновесия соответствует точке минимума свободной энергии Гельмгольца. Другими словами, в этой точке (для такой системы) никакие изменения макроскопических параметров невозможны.
Свободная энергия Гельмгольца и максимальная работа
Свободная энергия Гельмгольца получила своё название из-за того, что она является мерой работы, которую может совершить термодинамическая система над внешними телами.
Пусть система переходит из состояния 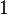 в состояние
в состояние  . Поскольку работа не является функцией состояния системы, работа, совершенная системой в данном процессе будет зависеть от пути, по которому этот переход будет осуществляться.
. Поскольку работа не является функцией состояния системы, работа, совершенная системой в данном процессе будет зависеть от пути, по которому этот переход будет осуществляться.
Зададимся целью определить максимальную работу, которую система может совершить в этом случае.
Можно показать, что эта максимальная работа равна убыли свободной энергии Гельмгольца:
· 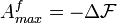 . Здесь индекс f означает, что рассматриваемая величина является полной работой системы в данном процессе (см. ниже).
. Здесь индекс f означает, что рассматриваемая величина является полной работой системы в данном процессе (см. ниже).
Свободные энергии Гельмгольца и Гиббса[править | править вики-текст]
В приложениях «свободной энергией» иногда называют не свободную энергию Гельмгольца, а энергию Гиббса. Это связано с тем, что энергия Гиббса также является мерой максимальной работы, но в данном случае рассматривается только работа над внешними телами, исключая среду:
Билет 50 вопрос 4
 2018-01-21
2018-01-21 3679
3679
