Концентрация раствора – количественное выражение его состава.
1. Молярные доли (дроби) показывают какую долю составляет число молей данного компонента от общего числа молей всех компонентов.
Пример. Компоненты А и В. Массы компонентов 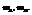 Число молей компонентов -
Число молей компонентов - 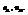
Молярная доля компонента А 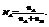
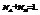
2. Процентное выражение концентрации 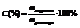
3. Концентрация, выражаемая через плотность раствора.
Вычисляется с помощью приборов (ареометр, пикнометр, лактометр) и специальных таблиц значений.
4. Молярная концентрация 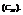
показывает сколько молей растворенного вещества в одном литре раствора.
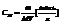 М – молекулярная масса вещества.
М – молекулярная масса вещества.
5. Моляльная концентрация 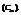
показывает сколько молей растворенного вещества приходится на 1000 грамм растворителя 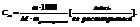
6. Нормальная концентрация 
показывает сколько грамм-эквивалентов растворенного вещества содержится в 1 литре раствора 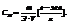
7. Титр – число граммов раствренного вещества в 1 мл раствора.
Пример. 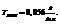
26. Постулат Планка.
При абсолютном нуле энтропия правильно образованного кристалла прочного вещества или соединения в чистом состоянии равна нулю, а при любом другом состоянии энтропия его больше нуля. 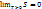
Энтропия – тепло переданное системе при постоянной температуре. Мера неупорядоченности системы.
Стандартная энтропия вещества обозначается символом S0T (p=101,3 кПа), её можно определить при любом значении температуры, однако для удобства сравнения величин ST0 для различных веществ их пределяют обычно при стандартных условиях. (р=101,1кПа; Т=298К) и обозначает S0298 (Дж/(моль*R)) всегда > 0.
Энтропия вещества тем выше, чем меньше упорядоченность частиц этого вещества. В интервале температур 0-298 К энтропия изменяется только за счёт повышения температуры, значит при р-const dS=dQP/T=Cp(dT/T).
 2018-01-21
2018-01-21 573
573








