Растворимость увеличивается с повышением температуры и почти не зависит от давления.
Существуют неограниченная растворимость и растворимость до известного предела.
1. жидкости смешиваются в любых пропорциях (спирт и вода).
2. имеет место расслаивание (образование двух слоев – верхний и нижний). пример: эфир и вода.
Расслаивание уменьшается с ростом температуры и исчезает при некоторой (критической) температуре.
7. Закон химических эквивалентов. Молярные массы эквивалентов сложных веществ.
Вещества вступают в реакцию в количествах, пропорциональных их эквивалентам.
Расчёт молярной массы эквивалента:
1) Хим. Элементы
Мэ=М/n, М – молярная масса, n- валентность.
2) Кислоты, основания
Мэ=М/н, М – молярная масса, н – основность кислоты, количество «ОН» групп.
3) Соли и оксиды
Мэ=М/(н*n), н – количество катионов, n – заряд катионов.
4) Окислители и восстаноители
Мэ=М/н, н – количество эелектронов, присоединяемое одной молекулой окисления и отдаваемое одной молекулой восстановления.
Молярная масса эквивалента – масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль.
Законы Рауля. Криоскопия и эбуллиоскопия
Особенность растворов: давление пара растворителя над раствором ниже, чем над чистым растворителем.
Первый закон.
Давление пара растворителя над раствором пропорционально мольной доле растворителя в растворе.
Или
Относительно понижение давление пара растворителя над раствором равно мольной доли растворенного вещества.
Введем обозначения:
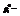 давление пара растворителя над чистым растворителем;
давление пара растворителя над чистым растворителем;
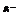 давление пара растворителя над раствором;
давление пара растворителя над раствором;
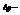 абсолютное понижение давления;
абсолютное понижение давления;
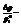 относительное понижение давления.
относительное понижение давления.
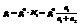
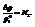
Если система полностью подчиняется закону, на графике наблюдаются прямолинейные зависимости. Однако в реальных системах наблюдаются отклонения.
Примечание автора. Обязательна графическая иллюстрация.

Температура замерзания раствора ниже температуры замерзания чистого растворителя, а температура кипения – выше.
Второй закон.
Повышение температуры кипения раствора и понижение температуры его замерзания пропорциональны моляльной концентрации раствора.
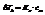
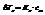 К – константа, характеризующая растворитель.
К – константа, характеризующая растворитель.
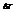 не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
не зависит от природы вещества, а определяется природой растворителя и моляльностью, т.е. числом растворенных молекул в определенном количестве растворителя.
С помощью законов Рауля можно определять неизвестные молекулярные массы растворенных веществ.
 2018-01-21
2018-01-21 1161
1161








