Закон действующих масс может быть применен к водным растворам кислот. Например, в водном растворе уксусной кислоты устанавливается следующее равновесие:

Константа этого равновесия определяется выражением

Величина Ка называется константой диссоциации кислоты. Ее размерность такая же, как размерность концентрации: моль/дм3. Константу диссоциации кислоты можно также выразить с помощью закона разбавления Оствальда:

где с-исходная концентрация кислоты, а а-степень диссоциации кислоты. Эту степень диссоциации можно установить, определяя молярные электропроводности раствора с заданной концентрацией, а также бесконечно разбавленного раствора (подробнее об этом см. в гл. 10).
Константа диссоциации кислоты является мерой силы этой кислоты. Для таких кислот, как соляная кислота, которая практически полностью диссоциирована в водном растворе, константа диссоциации имеет очень большую величину. И наоборот, для слабых кислот константа диссоциации K3 имеет чрезвычайно малые значения. Поэтому для сопоставления относительной силы кислот удобнее пользоваться вместо их констант диссоциации величинами рKа, которые определяются следующим выражением: 
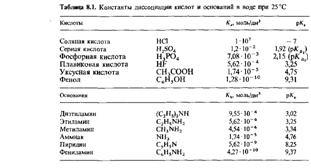

Для большинства известных кислот величина рКa принимает значения в интервале от 1 до 14. Сильные кислоты имеют низкие значения рКа, а слабые кислоты-высокие значения. В табл. 8.1 указаны значения Кл и рКл для некоторых кислот. Многопротонные кислоты, как, например, H2SO4 и H3PO4, характеризуются несколькими константами диссоциации.
Сильные основания характеризуются низкими значениями рКь, а слабые основания-высокими значениями. Значения Кь и рКь для некоторых оснований приведены в табл. 8.1.
Оствальда закон разбавления, соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
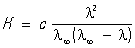 .
.
Здесь К — константа диссоциации электролита, с — концентрация, l и l¥ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием действующих масс закона и равенства l/l¥ = a, где a — степень диссоциации. Оствальда закон разбавления выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности Оствальда закона разбавления имело большое значение для обоснования теории электролитической диссоциации.
ОСНОВАНИЯ, КИСЛОТЫ И СОЛИ В ТЕОРИИ ЭД.
Основания. Название "основание" первоначально было отнесено к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов.
Примеры: NaOH - гидроксид натрия (едкий натр), KOH - гидроксид калия (едкое кали), Ca(OH)2 - гидроксид кальция (гашёная известь).
Основания, которые хорошо растворяются в воде, называются щелочами, К ним относятся гидроксиды щелочных и щелочно-земельных металловС точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид - ион
NaOH  Na++ OH- Ba(OH)2 Na++ OH- Ba(OH)2  Ba2++ 2OH- NH3·H2O Ba2++ 2OH- NH3·H2O 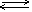 NH4++ OH- NH4++ OH- |
Кислоты. Кислоты исторически получили своё название из-за кислого вкуса водных растворов тактх веществ, как хлороводород или уксусная кислота. С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остатка
H2SO4 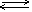 2H+ + SO42- CH3COOH 2H+ + SO42- CH3COOH 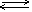 H+ = CH3COO- H+ = CH3COO- |
Соли. С точки зрения теории электролитической реакции соли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
Соль -> Катион основания + Анион кислотного остатка
BaCl2 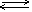 Ba2+ + 2Cl- K2CO3 Ba2+ + 2Cl- K2CO3 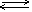 K+ + CO32- K+ + CO32- |
Билет 24.
 2018-01-21
2018-01-21 3083
3083
