1. Соль, образованная слабой кислотой и сильным основанием. Уравнение гидролиза соли ацетата натрия в молекулярной форме:

В ионной форме уравнение имеет вид:

Применяя к этому обратимому процессу закон действующих масс, запишем выражения для скоростей прямой и обратной реакций:

где k1 и k2 – константы скорости прямой и обратной реакций соответственно.
Как и любой другой обратимый процесс, реакция гидролиза заканчивается установлением химического равновесия, т. е. такого состояния системы, когда скорости прямой и обратной реакций равны: v1 = v2.
Откуда

Константа химического равновесия К равна отношению константы скорости прямой реакции к константе скорости обратной реакции.
Таким образом,
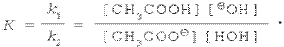
Концентрацию воды в растворе допускается считать величиной постоянной, поэтому объединим [НОН] и К.
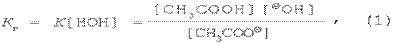
где Кг – константа гидролиза.
Известно, что

где К(H2O) – ионное произведение воды.
Подставляя выражение для  в уравнение константы гидролиза (1), получим:
в уравнение константы гидролиза (1), получим:

Однако

Тогда окончательно имеем:

Степенью гидролиза b называется отношение количества гидролизованной соли к общему количеству растворенной соли.
Определим степень гидролиза соли, образованной слабой кислотой и сильным основанием. Пусть в реакции гидролиза соли ацетата натрия начальная концентрация ее, а значит, и ацетат-ионов (т. к. соль – сильный электролит) равна с. Тогда равновесные концентрации примут значения:

Подставим эти выражения в уравнение константы гидролиза (1):

Воспользовавшись уравнением (2), получим:

Для многих солей b – величина небольшая (обычно b<<0,01), поэтому с известным приближением можно принять 1–b»1. Тогда уравнение (3) примет вид:

2. Соль, образованная сильной кислотой и слабым основанием. Уравнение гидролиза соли хлорида аммония в молекулярной форме:

В ионной форме уравнение имеет вид:

Применяя закон действующих масс, запишем:

В состоянии химического равновесия v1=v2, поэтому

Откуда

Объединяя [НОН] и К, получим:

Известно, что 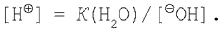
Подставим это выражение в уравнение (5) и получим:

Зная, что

имеем окончательное выражение:

Выведем уравнение для степени гидролиза соли, образованной слабым основанием и сильной кислотой.
Пусть в реакции гидролиза соли хлорида аммония ее начальная концентрация, а значит, и концентрация катионов аммония (т. к. соль – сильный электролит) равна с. Тогда равновесные концентрации приобретут значения:

Подставим эти выражения в уравнение для константы гидролиза (5):

Воспользовавшись уравнением (6), получим:

Допустив, что 1–b»1, преобразуем уравнение (7):

3. Соль, образованная слабой кислотой и слабым основанием. Уравнение гидролиза соли цианида аммония в молекулярной и ионной формах:

Применим закон действующих масс к данному обратимому процессу:

В состоянии химического равновесия cкорость прямой реакции равна скорости обратной реакции:

Константа химического равновесия – это отношение константы скорости прямой реакции к константе скорости обратной реакции:

Как и в предыдущих случаях, объединим K и [НОН]:

Умножим числитель и знаменатель в уравнении (9) на величину ионного произведения воды:

Зная, что

преобразуем выражение для константы гидролиза (10).
В результате получим:

Выразим степень гидролиза соли, образованной слабой кислотой и слабым основанием.
Пусть исходная концентрация соли цианида аммония в реакции гидролиза равна с. Исходные концентрации катиона аммония и цианид-аниона также можно считать равными с (помня, что соль – сильный электролит). Тогда равновесные концентрации примут значения:

Подставляя выражения равновесных концентраций в уравнение константы гидролиза (9) получим:
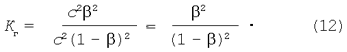
Приравниваем правые части уравнений (11) и (12):

Из уравнений (4), (8), (13) следует, что степень гидролиза тем больше:
- чем больше величина К(H2O), т. е. чем выше температура, т. к. ионное произведение воды возрастает с повышением температуры;
- чем меньше константы диссоциации Кд электролитов, образующих соль, т. е. чем слабее электролиты, остатки которых входят в состав соли;
- чем меньше концентрация соли в растворе, т. е. чем больше степень разбавления раствора (вывод следует из уравнений (4) и (8)).
Например, при добавлении к раствору хлорида сурьмы(III) дистиллированной воды наблюдается образование осадка SbOCl, что свидетельствует о протекании реакции гидролиза соли SbCl3 по второй ступени. Именно вторая ступень гидролиза хлорида сурьмы(III) приводит к образованию основной соли Sb(ОН)2Сl, разложение которой и дает осадок хлорида оксосурьмы.

Таким образом, разбавляя раствор, смещаем равновесие реакции гидролиза вправо.
Если гидролиз – явление нежелательное, то работать следует с концентрированными растворами при пониженных температурах. Полезно также добавить к раствору соли избыток одного из образующихся при гидролизе продуктов (кислоты или щелочи, в зависимости от реакции среды раствора), тем самым способствуя смещению химического равновесия реакции влево в соответствии с принципом Ле Шателье.
Так, если к раствору с осадком SbОСl прилить соляную кислоту, то осадок растворится. Если затем вновь в раствор добавить воду, то наблюдается повторное образование осадка.
Описанные явления согласуются с ранее сделанными выводами о влиянии разбавления раствора на степень гидролиза, а также подтверждают обратимый характер процесса и возможность смещения химического равновесия реакции гидролиза.
Билет 26.
 2018-01-21
2018-01-21 2117
2117
