Диполь- дипольный механизм
И электролит, и вода являются диполями. Два диполя притягиваются друг к другу, взаимно усиливая диполи. Оба полюса молекулы электролита оказываются гидратированными молекулами воды. Затем происходит полный разрыв молекулы электролита. В конечном итоге картина та же самая: гидратированные ионы уходят в раствор, рис.1.
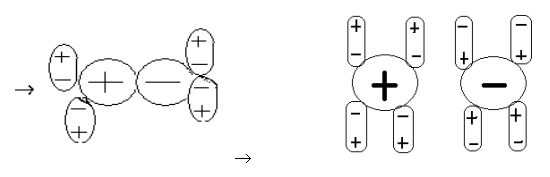
Рис.1
Суть диссоциации слабых электролитов в том, что они диссоциируют на ионы не полностью, обратимо.
Диссоциация слабых электролитов:
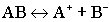 .
.
Диссоциация слабых электролитов имеет две количественные характеристики:
1) λ - степень диссоциации. Степень диссоциации не является константой, она зависит от двух факторов:
· от температуры (прямая зависимость);
· от концентрации раствора (обратная зависимость).
2) Константа диссоциации - это, по сути, константа равновесия обратимой реакции.
Кр=КД=[A+]р*[B+]р/[AB]р.
Константа диссоциации изменяется с температурой, причём зависимость прямая. От концентрации растворов константа диссоциации не зависит.
Взаимосвязь между степенью и константой диссоциации установил немецкий химик Оствальд.
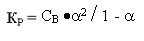 .
.
Для слабых электролитов степень диссоциации много меньше единицы и поэтому в знаменателе формулы закона Оствальда ею пренебрегают.
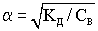 - закон разбавления Оствальда.
- закон разбавления Оствальда.
Многие слабые электролиты диссоциируют ступенчато. Каждая ступень имеет свою константу диссоциации
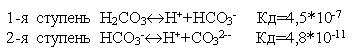 .
.
По первой ступени диссоциация заметна при нормальных условиях (при комнатной температуре).
Диссоциация по второй ступени заметна при повышенной температуре, особенно при температуре кипения.
Всегда
Кд1>Кд2>Кд3
Сr(OH)3
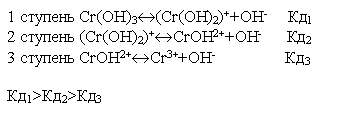 .
.
 2014-01-31
2014-01-31 1408
1408
