Максимальная положительная степень окисления элемента обычно совпадает с номером его группы в периодической системе.
Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления - минус восемь.
Исключение составляют фтор, кислород, железо: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся.
У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе.
Степенью окисления характеризуют валентность элементов в соединениях с ионными связями, которые соответствует величине заряда иона элемента в данном соединении.
Использование понятия степени окисления для атомов элементов, образующих другие виды химической связи, не всегда корректно и требует большой осторожности.
Билет 4 Сравните строение атомов Азота (Нитрогена) и Фосфора, объясните степени окисления, что они выявляют (возбужденное состояние атома)
Между Азотом 7N и Фосфором 15P - типическими элементами пятой группы наблюдается значительное различие в свойствах.
В состоянии простых веществ азот – газ, а фосфор – твердое вещество.
Азот и Фосфор – элементы пятой группы, основной подгруппы. Строение электронной оболочки этих атомов схоже, оба на последнем энергетическом уровне содержат по 5 электронов.
Но Азот во втором периоде – т.е. 2 энергетичских уровня
А Фосфор в третьем периоде – т.е. 3 энергетичских уровня
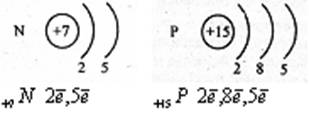
Распределение электронов в атоме азота:ls22s2 2p3.
Распределение электронов в атоме фосфора: ls22s22p63s23p33d°.
Валентность атомов фосфора в невозбужденном состоянии равна III, в возбужденном состоянии — V.
Азот не бывает пятивалентным (так как на втором энергетическом уровне нет d-подуровня), но степень окисления, как условный заряд, может быть +5
Атом азота в невозбужденном состоянии характеризуется тремя 2р-электронами при наличии двух спаренных электронов на 2s-орбитали.
 2018-01-21
2018-01-21 1480
1480
