Пример:
Тепловым эффектом реакции называется количество выделяющейся или поглощающейся при реакции теплоты.
2Al + 3S = Al2S3 + Q
CaCO3 = CaO + CO2 - Q
Тепловой эффект реакции водорода с кислородом равен 571,6 кДж.
2H2 + O2 = 2H2O + 571,6 кДж
В реакции образуется 2 моль воды, значит теплота образования воды равна 285,8 кДж.
Теплотой сгорания вещества называется теплота, выделяющаяся при сгорании 1 моль вещества.
CH4 + O2 = CO2 + 2H2O + 880 кДж.
3)

4) Пусть нам дан объем раствора Vр-ра = 1 л
Масса раствора
Мр-ра = ρ* Vр-ра = 1050*1 = 1050 г (ρ = 1,05 г/см3 = 1050 г/л)
Масса чистого вещества HNO3 в растворе
m(HNO3) = w(HNO3)* Мр-ра/100% = 20*1250/100 = 210 г
Количество вещества HNO3
n(HNO3) = m(HNO3)/M (HNO3) = 210/63 = 3,33 моль
Молярная концентрация
См = n(HNO3)/Vр-ра = 3,33/1 = 3,33 моль/л.
Билет № 5.

1) Эквивалент [fэкв (B) – это реальная или условная часть вещества, которая в реакции может присоединять, замещать либо соответствовать одному атому или иону водорода (H, H+) или одному молю водорода (H, H+), а в окислительно-восстановительных реакциях - одному электрону или одному молю электронов.
Молярная масса эквивалента вещества
[M(1/z B)] – это масса моля эквивалента вещества, равная произведению его молярной массы на фактор эквивалетности.
[M(1/z B)] = fэкв * M = 1/z * M
Молярная масса эквивалента кислоты равна ее молярной массе, деленной на основность кислоты.
Молярная масса эквивалента основания равна его молярной массе, деленной на число гидроксильных групп (n OH-), участвующих в обмене.
Молярная масса эквивалента соли равна ее молярной массе, деленной на произведение заряда катиона металла на число катионов в молекуле соли.
Молярная масса эквивалента простого вещества равна его молярной массе, деленной на валентность.
Массы реагирующих без остатка веществ пропорциональны их эквивалентам или молярным массам эквивалентов.
m(A) M(1/zA)
m(B) M(1/zB)
Если одно из веществ находится в газовом состоянии, закон можно записать иначе:
m(A) V0(газа)
M(1/zA) Vэкв(газа)
Здесь V0 и Vэкв – объем газа и объем эквивалента газа, соответственно.
Решение. В оксиде металла на кислород приходится:
9,44 – 5,00 = 4,44 г кислорода
По закону эквивалентов:
Массы реагирующих веществ относятся между собой как эквиваленты этих веществ.
Эквивалент кислорода равен 8. Отсюда:
На 5 г металла — 4,44 г кислорода
Э металла— Э кислорода (8)
Э металла = 8*5/ 4,44 = 9,01 г/моль (уравнения)
Ответ: эквивалент металла равен 9,01 г/моль.
2) Объясните, что такое теплота образования. Её обозначения и размерность. Расчет тепловых эффектов реакций через теплоты образований соединений. Приведите пример.
Теплота образования - энтальпия образования. Изобарный тепловой эффект химической реакции образования данного химического соединения из простых веществ, отнесенный к одному молю.
Энтальпия – характеризует энергетическое состояние вещества, но включает энергию, затрачиваемую на преодоление внешнего давления.
Обозначение и размерность. Энтальпия образования химического соединения (∆ H 0f, кДж/моль) – изменение энтальпии при образовании 1 моля сложного вещества из простых. ∆Hобр.= - ∆ Hразл.
Расчет тепловых эффектов реакции равен сумме теплу сгорания исходящих веществ за минусом, суммы теплоты сгорания продуктов реакции.
Пример:
Тепловым эффектом реакции называется количество выделяющейся или поглощающейся при реакции теплоты.
2Al + 3S = Al2S3 + Q
CaCO3 = CaO + CO2 - Q
Тепловой эффект реакции водорода с кислородом равен 571,6 кДж.
2H2 + O2 = 2H2O + 571,6 кДж
В реакции образуется 2 моль воды, значит теплота образования воды равна 285,8 кДж.
Теплотой сгорания вещества называется теплота, выделяющаяся при сгорании 1 моль вещества.
CH4 + O2 = CO2 + 2H2O + 880 кДж.
3) -???
4)

Билет безликий.

1. Авогадро - в равных объемах (V) различных газов, взятых при одинаковой температуре и давлении содержит одно и то же число молекул.
Следствие 1: Одинаковое число молекул различных газов при одинаковых условиях занимают одинаковый объем.
Стандартные условия:
Температура: 0°С = 273,15 K
Давление: 1 атм = 1,013 * 105 Па
В этих условиях объем одного моля любого идеального газа равен 22,4 л.
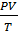 =
= 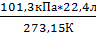
Следствие 2: Молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.

2) Объясните, что такое теплота образования. Её обозначения и размерность. Расчет тепловых эффектов реакций через теплоты образований соединений. Приведите пример.
Теплота образования - энтальпия образования. Изобарный тепловой эффект химической реакции образования данного химического соединения из простых веществ, отнесенный к одному молю.
Энтальпия – характеризует энергетическое состояние вещества, но включает энергию, затрачиваемую на преодоление внешнего давления.
Обозначение и размерность. Энтальпия образования химического соединения (∆ H 0f, кДж/моль) – изменение энтальпии при образовании 1 моля сложного вещества из простых. ∆Hобр.= - ∆ Hразл.
Расчет тепловых эффектов реакции равен сумме теплу сгорания исходящих веществ за минусом, суммы теплоты сгорания продуктов реакции.
Пример:
Тепловым эффектом реакции называется количество выделяющейся или поглощающейся при реакции теплоты.
2Al + 3S = Al2S3 + Q
CaCO3 = CaO + CO2 – Q
Тепловой эффект реакции водорода с кислородом равен 571,6 кДж.
2H2 + O2 = 2H2O + 571,6 кДж
В реакции образуется 2 моль воды, значит теплота образования воды равна 285,8 кДж.
Теплотой сгорания вещества называется теплота, выделяющаяся при сгорании 1 моль вещества.
CH4 + O2 = CO2 + 2H2O + 880 кДж.
3)
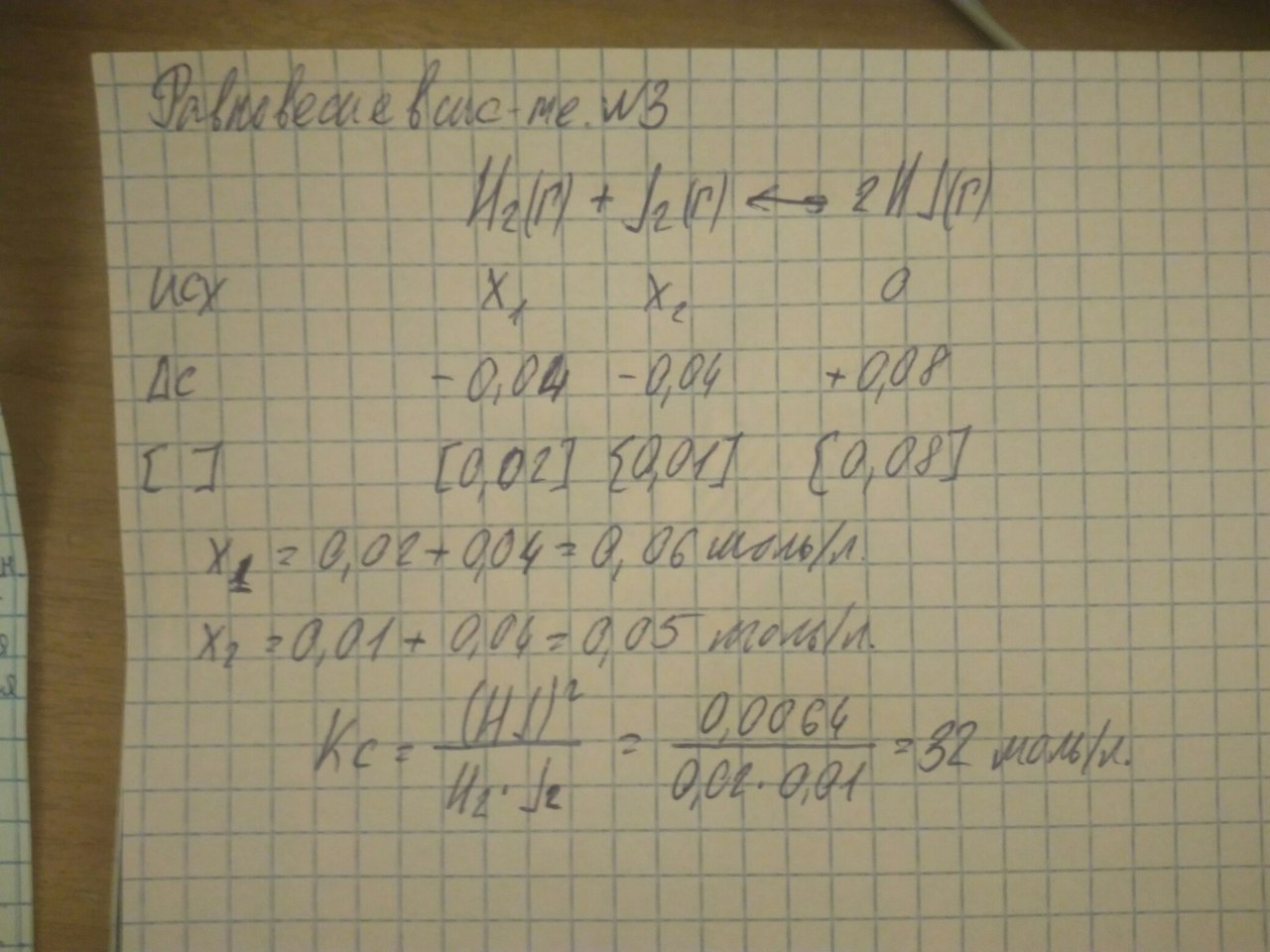
4) N 2+3H2=>2NH3
V= к*Р(N2)*P(H2)3
V 2=k*2P(N2)*(2P(H2))3
V 2 k*2P(N2)*(2P(H2))3 16
V k*Р(N2)*P(H2)3
Ответ: V реакция увеличивается в 16 раз.
Билет № 12.

1) Кд= C*£2
(1-£) Это уравнение - математическое выражение закона разбавления Оствальда, который устанавливает зависимость между степенью диссоциации слабого электролита и его концентрации.
Вычислите константу диссоциации циановодородной кислоты, если степень диссоциации ее в растворе с концентрацией HCN 0.001 моль/л равна 1,8%.

Константа и степень гидролиза солей. Зависимость их от температуры и разбавления.
Гидролизом называется взаимодействие вещества с водой, в котором составные части вещества соединяются с составными частями воды.
Константа гидролиза
CN- + H2O «HCN + OH-
Константу равновесия процесса гидролиза называют константой гидролиза.
Kг = [HCN] * [OH-] / [CN-].
Выразим [OH-] через Kw: [OH-] = Kw / [H+]. Тогда
Kг = Kw * [HCN] / ([CN-] * [H+]) = Kw / Ka, поскольку
Ka = [CN-] * [H+]/ [HCN]
При гидролизе по аниону Kг = Kw / Ka
При гидролизе по катиону Kг = Kw / Kb
При гидролизе по катиону и аниону Kг = Kw / (Ka * Kb)
Степень гидролиза
Степенью гидролиза (h) называют мольную долю и мольный процент ионов, подвергшихся гидролизу.
h = Cгидр / Собщ
h (%) = (Cгидр / Собщ) * 100%
Степень гидролиза и константа связаны между собой также, как степень и константа диссоциации:
Kг = c*h2/(1-h)
Если степень гидролиза мала, то 1-h» 1. Тогда: Kг = c*h2
h =Ö(Kг/c)
Зависимость от температуры и разбавления:
- Температура – с ростом температуры гидролиз усиливается, поскольку реакции гидролиза эндотермические.
- Добавление кислоты или основания – смещают равновесие
3)

4)

Билет №8

1. N2 + 3H2 ↔ 2NH3
А) увеличить концентрацию продуктов реакции
Б) снизить температуру (реакция экзотермическая, т.к. ΔH°<0), а повышение температуры при экзотермической реакции приводит к уменьшению выхода продукта
В) увеличить давление
- Концентрация раствора – количественная мера того, сколько вещества растворено в растворителе.
Массовая доля – отношение массы растворённого вещества к общей массе раствора. Молярная концентрация – количество молей растворённого вещества а одном литре раствора.
Нормальная концентрация – количество молей эквивалентов растворённого вещёства в одном литре раствора.
3. A) Sc(OH)3 + 3CH3COOH = Sc(CH3COO)3 + 3H2O
Sc+3OH+3 CH3COO+3H = Sc+3 CH3COO + 3H+3OH
3OH +3H = 3H2O
b) 2CaCl2+Na2SO4= CaSO4 + 2NaCl
Ca+2Cl+2Na+SO4 = CaSO4 + 2Na+2Cl
Ca+SO4 = CaSO4
4.
Билет№4

1. Парциа́льное давление — давление отдельно взятого компонента газовой смеси (то давление, которое оказывал бы газ, входящий в газовую смесь, если бы из нее были удалены все остальные газы при условии сохранения постоянными температуры и объема). Общее давление газовой смеси является суммой парциальных давлений её компонентов.
Общее давление газовой смеси определяется законом Дальтона: общее давление смеси газов, занимающих определенных объем, равно сумме парциальных давлений, которыми обладал бы каждый отдельно взятый газ, если бы он занимал объем, равный объему смеси газов.
Р = Р 1 + Р 2 + Р 3 + … + Рк, P1,2,3… = nRT/V
где Р – общее давление;
Рк – парциальное давление компонентов
Задача.
Кислород увеличился после смешивания 6/2=3раза, объем диоксида серы- в 6/4=1,5раза. Во столько же раз уменьшились парциальные давления газов. Следовательно, Р(О2)=20/3=6,6 кПа, Р(SO2)=20/1,5=13.3 кПа.
2.
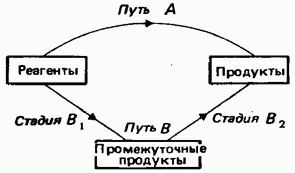
Первый закон термохимии (Лавуазье и Лаплас, 1780—1784): тепловой эффект образования данного соединения в точности равен, но обратен по знаку тепловому эффекту его разложения.
Второй (Основной) закон термохимии (закон Гесса): Тепловой эффект химической реакции не зависит от пути проведения процесса, числа и вида промежуточных стадий, а зависит только от начального и конечного состояния реагирующих веществ, при условии постоянства давления или постоянства объёма
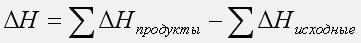
3. T1=50c. t1=135cек. T2=70c. t2=? Y=3
 3 в степени (70-50)/10= 3 в квадрате= 9
3 в степени (70-50)/10= 3 в квадрате= 9
Скорость возросла в 9 раз, т.е. реакция прошла в 9 раз быстрее, значит времени затратилось в 9 раз меньше. 135сек/9= 15сек - ответ
4.
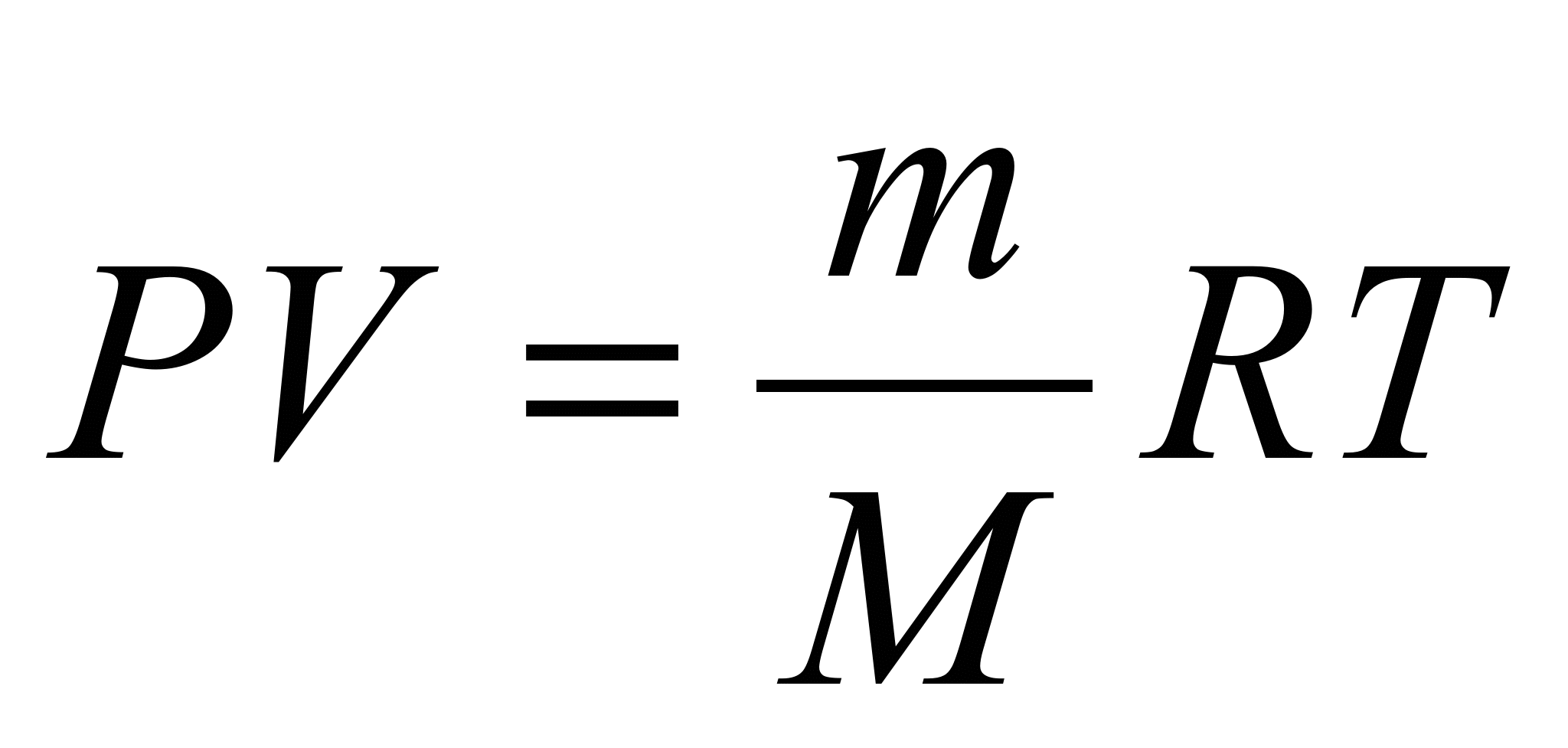 v=mRT/MP
v=mRT/MP
m=1.1кг
T=27c=27+273=300K
P=100kПа=100000Па
M=0.02898кг/моль
R = 8,314 Дж
v=mRT/MP=1,1*8,31*300/0,02898*100000=0,946л - ответ
Билет№14

1) Лимитирующий реагент —реагент, присутствующий в реакционной смеси в минимальном стехиометрическом количестве. Выход конечного (целевого) продукта, который образуется в процессе данной реакции, ограничен содержанием лимитирующего реагента.
2) Выход реакции - отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца.
Металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Проведем диагональ (можно мысленно) между двумя точками: начнем от Be (бериллий) и закончим на At (астат). Деление это конечно условно, но все-таки позволяет объединять химические элементы в соответствии с их свойствами. Элементы, находящиеся слева под диагональю, и будут металлами. Чем левее, относительно диагонали, расположение элемента, тем более выражены будут у него металлические свойства:
* кристаллическая структура - плотная,
*теплопроводность - высокая,
*электрическая проводимость, уменьшающаяся с повышением температуры,
*уровень степени ионизации - низкий (электроны отделяются свободно)
*способность к образованию соединений (сплавы),
*растворимость (растворяются в сильных кислотах и едких щелочах),
*окисляемость (образование оксидов).
Для всех металлов характерна металлическая кристаллическая решетка: в ее узлах находятся положительно заряженные ионы, а между ними свободно перемещаются электроны. Наличие последних объясняет высокую электропроводность и теплопроводность, а также способность поддаваться механической обработке.
Теплопроводность и электропроводность уменьшается в ряду металлов:
Аg Сu Аu Аl Мg Zn Fе РЬ Hg
Все металлы делятся на две большие группы:
Черные металлы
Имеют темно-серый цвет, большую плотность, высокую температуру плавления и относительно высокую твердость.
Типичным представителем черных металлов является железо.
Цветные металлы
Имеют характерную окраску: красную, желтую, белую; обладают большой пластичностью, малой твердостью, относительно низкой температурой плавления.
Типичным представителем цветных металлов является медь.
В зависимости от своей плотности металлы делятся на:
Легкие (плотность не более 5 г/см)
К легким металлам относятся: литий, натрий, калий, магний, кальций, цезий, алюминий, барий.
Самый легкий металл — литий 1л, плотность 0.534 г/см3.
Тяжелые (плотность больше 5 г/см3).
К тяжелым металлам относятся: цинк, медь, железо, олово, свинец, серебро, золото, ртуть и др.
Самый тяжелый металл — осмий, плотность 22,5 г/см3.
Металлы различаются по своей твердости:
— мягкие: режутся даже ножом (натрий, калий, индий);
— твердые: металлы сравниваются по твердости с алмазом, твердость которого равна 10. Хром — самый твердый металл, режет стекло.
В зависимости от температуры плавления металлы условно делятся на:
1. Легкоплавкие (температура плавления до 1539°С).
К легкоплавким металлам относятся: ртуть — температура плавления —38,9°С; галлий — температура плавления 29,78°С; цезий — температура плавления 28,5°С; и другие металлы.
2. Тугоплавкие (температура плавления выше 1539 С).
К тугоплавким металлам относятся: хром — температура плавления 1890°С; молибден — температура плавления 2620°С; ванадий — температура плавления 1900°С; тантал — температура плавления 3015°С; и многие другие металлы.
Самый тугоплавкий металл вольфрам — температура плавления 3420°С.
3)

4)

Билет№15

1)Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2).
Оксиды делят на кислотные, осно́вные, амфотерные и несолеобразующие (безразличные).
Кислотным оксидам соответствуют кислоты. Кислотными свойствами обладают большинство оксидов неметаллов и оксиды металлов в высшей степени окисления, например CrO3.
Многие кислотные оксиды реагируют с водой с образованием кислот. Например, оксид серы (IV), или серни́стый газ, реагирует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
Кислотные оксиды реагируют со щелочами с образованием соли и воды. Например, оксид углерода (IV), или углекислый газ, реагирует с гидроксидом натрия с образованием карбоната натрия (соды):
CO2 + 2NaOH = Na2CO3 + H2O
Осно́вным оксидам соответствуют основания. К осно́вным относятся оксиды щелочных металлов (главная подгруппа I группы),
магния и щелочноземельных (главная подгруппа II группы, начиная с кальция), оксиды металлов побочных подгрупп в низшей степени окисления (+1 +2).
Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований. Так, оксид кальция реагирует с водой, получается гидроксид кальция:
CaO + H2O = Ca(OH)2
Основные оксиды реагируют с кислотами с образованием соли и воды. Оксид кальция реагирует с соляной кислотой, получается хлорид кальция:
CaO + 2HCl = CaCl2 + H2O
Амфотерные оксиды реагируют и с кислотами, и со щелочами. Так, оксид цинка реагирует с соляной кислотой, получается хлорид цинка:
ZnO + 2HCl = ZnCl2 + H2O
Оксид цинка взаимодействует и с гидроксидом натрия с образованием цинката натрия:
ZnO + 2NaOH = Na2ZnO2 + H2O
С водой амфотерные оксиды не взаимодействуют. Поэтому оксидная пленка цинка и алюминия защищает эти металлы от коррозии.
Несолеобразующим (безразличным) оксидам не соответствуют гидроксиды, они не реагируют с водой. Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относится оксид азота (II) NO.
Про основные свойства:
Если оксиды одного хим. элемента. то по степени окисления. Если оксиды лдного периода то их кислотность увеличивается в периоде слева направо. Если сравниваются оксиды у элементов одной группы. то кислотные свойства ослабевают сверху вниз.
Ответ: у SnO2 основные свойства выше, тк он ниже в таблице
2) Энтальпия системы – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением
Стандартная мольная энтальпия - изменение энтальпии при стандартных условиях в расчёте на 1 моль реакции, т.е. в соответствии со стехиометрическим уравнением реакции
Стандартная мольная энтальпия образования - изменение энтальпии при образовании 1 моля вещества из входящих в него элементов при стандартных условиях. Стандартные мольные энтальпии образования простых веществ равны нулю.
H2(г)+0.5 O2(г)=Н2О(ж)
Стандартная мольная энтальпия сгорания - изменение энтальпии при полном сгорании в кислороде одного моля вещества при стандартных условиях
С3Н6(г)+4,5 О2(г) -> 3 СО2(г)+3Н2О(ж)
3)

4)
Билет 19.

1) 1 Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
график изохорического процесса на РТ- и VT-диаграммах (рис. 1.6). Уравнение изохоры:
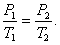
Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде
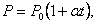
где Р0 – давление при 0 °С, α - температурный коэффициент давления газа равный 1/273 град-1.
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
графики изобарического процесса на РV- и РT-диаграммах
Уравнение изобары:
. 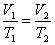
Если температура газа выражена в градусах Цельсия, то уравнение изобарического процесса записывается в виде 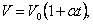
где α =1/273 град -1- температурный коэффициент объёмного расширения.
3. Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
График изотермического процесса на РV-диаграмме называется изотермой. Полезно знать графики изотермического процесса на VT- и РT-диаграммах
Уравнение изотермы:
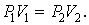
Закон Авогадро
 2018-01-21
2018-01-21 1425
1425







