По мере протекания реакции исходные вещества расходуются, их концентрация уменьшается и уменьшается скорость прямой реакции. Одновременно появляются продукты реакции, концентрация возрастает, и скорость обратной реакции постоянно увеличивается. Когда скорости становятся одинаковыми, наступает химическое равновесие.
V1=V2
Хим. равновесие является динамическим (подвижным). При неизменных условиях может сохраняться сколь угодно долго.
Термодинамические условия равновесия: ∆S=0 (энтропия), ∆G=0 (количество свободной энергии)
Константа равновесия – отношение констант скоростей прямой и обратной реакций.
Кравн=К1/К2
Необратимые (односторонние) – протекают до конца, до полного израсходования одного из реагирующих веществ (в одном направлении).
Обратимые (двусторонние) – протекают не до конца, ни одно из реагирующих веществ не расходуется полностью (как в прямом, так и в обратном направлении). Одновременно, при одинаковых условиях.
Уравнение изобары хим. реакции: d*ln*Kp = dT = ∆H/RT
∆H-тепловой эффект реакции, протекающей при постоянном давлении
Уравнение изотермы хим. реакции: ∆G= - RT lnKp + RT ln PMm* PNn/ PAa * PBb
Смещение равновесия – изменение равновесных концентраций всех реагирующих веществ, вызванное изменение какого-либо условия.
Смещение может быть обеспечено:
- Изменением концентрации
- Изменением температуры (если реакция с тепловым эффектом)
- Изменением объема (в реакциях, протекающих в газовой фазе)
Принцип Ле-Шателье-Брауна (1884): если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (t, P, C), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Состояние системы, при котором ее параметры со временем не меняются, но происходит обмен веществом и энергией с окружающей средой называется стационарным. Для живых организмов характерно постоянство параметров стационарного состояния во времени, которое называется – гомеостаз.
Сходство химического равновесия со стационарным состоянием заключается в неизменности во времени (сохраняет свои параметры), а отличие между ними заключается в двух признаках: ∆G ≠ 0 – для стационарного состояния,
Энтропия при стационарных состояниях минимальна, а при химическом равновесии – максимальна.
№10
Растворы – гомогенные (однородные) системы, состоящие минимум из 2 компонентов, соотношения которых могу меняться в широких пределах и продуктов их взаимодействия.
Роль: важнейшие биологические жидкости – кровь, лимфа, слюна и тд. Являются растворами солей белков, углеводов и липидов в воде; биохимические реакции в организме протекают в растворах; усвоение пищи происходит с переходом пищеварительных веществ в растворенное состояние; в жидких средах организма поддерживается постоянство кислотности, концентраций солей и органических веществ.
Вода – универсальный растворитель, состоит из 42 веществ (соединение 3 изотопов атома кислорода и водорода).
Особенности:
· Обладает аномально высокой темплоемкостью 4,18 Дж/г*К
· Её плотность в твердой фазе меньше плотности в жидкой фазе. Максимальная плотность 0,998 г/см3 при 4 градусах
· Необычно высока диэлектрическая проницаемость = 78 (число раз, в которое понижается действие зарядов друг на друга при переносе их из вакуума в объем растворителя)
Роль: Дееспособность всех живых клеток связана с присутствием воды. Рассматривая значение воды для человека, мы находим, что его организм – это совокупность водных растворов, коллоидов, суспензий и других сложных по составу водных систем.
Вода доставляет в клетки организма питательные вещества (витамины, минеральные соли) и уносит отходы жизнедеятельности (шлаки). Кроме того, вода участвует в процессе терморегуляции (потоотделение) и в процессе дыхания (человек может дышать абсолютно сухим воздухом, но не долго) Для нормальной работы всех систем человеку необходимо как минимум 1,5 литра воды в день.
· Способность к образованию водородных связей
· Особые хим. и физ. свойства
· Способность к диссоциации на H3O и OH
· Возможность к участию в качестве структурных единиц в макромолекулах
· Основа мембранного транспорта
· Основа транспорта веществ
Диаграмма состояния воды:
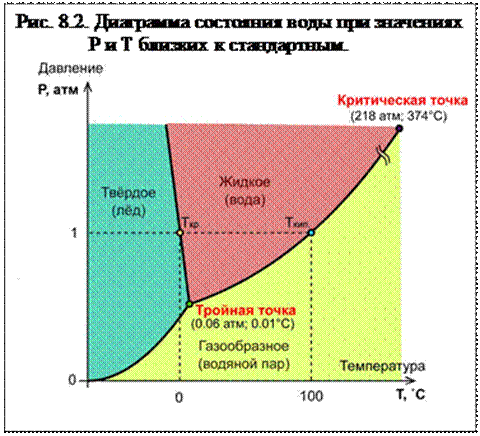
Растворимость – способность вещества растворяться в том или ином растворителе, количество граммов вещества на 100 г воды.
Термин гидрофильный часто применяют по отношению к веществам или группам, притягивающим воду, а термин гидрофобный применяют по отношению к веществам или группам, отталкивающим воду и притягивающим углеводороды.
Вещества, состоящие из небольших неполярных молекул, например кислород, азот и метан, растворяются в воде примерно в 10 раз хуже, чем в неполярных растворителях. Вещества, состоящие из более крупных неполярных молекул, по существу не растворяются в воде, но, как правило, хорошо растворяются в неполярных растворителях. Соединения, подобные бензину и нафталину, не растворяются в воде, поскольку их молекулы в растворе мешали бы молекулам воды образовывать столь же большое число прочных водородных связей, как в чистой воде; с другой стороны, борная кислота растворима в воде потому, что уменьшение числа связей между молекулами воды компенсируется образованием прочных водородных связей между молекулами воды и гидроксильными группами молекул борной кислоты.
Когда говорят, что вещество «растворимо», то под этим понимают, что растворимость его превышает при мерно 1 г в 100 мл (примерно 0,1 М по катиону), а когда говорят, что вещество «нерастворимо», то это значит, что растворимость его не превышает 0,1 г в 100 мл
Гидрофильные вещества хорошо растворимы в воде. Это моносахариды, олигосахариды, газы
(кислород, углекислый газ), соли, некоторые кислоты, т. е. полярные вещества. Гидрофильны все тела, в которых интенсивность молекулярных (атомных, ионных) взаимодействий достаточно велика. Особенно резко выражена гидрофильность минералов с ионными кристаллическими решётками (например, карбонатов, силикатов, сульфатов, глин и др.), а также силикатных стекол.
Гидрофобны металлы, лишённые окисных плёнок, органические соединения с преобладанием углеводородных групп в молекуле (например, парафины, жиры, воски, некоторые пластмассы), графит, сера и др. вещества со слабым межмолекулярным взаимодействием.
Гидрофобными являются нуклеиновые кислоты, некоторые белки. Это неполярные вещества.
Влияние T на растворимость:
Растворение большинства веществ в воде сопровождается поглощением теплоты (затрата энергии на разрушение кристаллической решетки)
С увеличением температуры растворимость твердого вещества увеличивается. Растворимость газов с повышением температуры, уменьшается.
Растворимость газов в воде – экзотермический процесс (так как у них нет кристаллической решетки)
Растворимость большинства газов растет с ростом давления и уменьшается с ростом температуры. Для твердых и жидких веществ влияние давления на растворимость менее значимо, чем для газов.
Наличие в растворителе других веществ может сильно влиять на растворимость. Примеры: 1) добавление в водный раствор неполярных веществ солей может привести к выделению неполярного вещества в осадок, за счет эффекта высаливания, 2) наличие растворенного кислорода сильно влияет на растворимость ртути в воде за счет эффектов поверхностного окисления, 3) наличие небольшого количества влаги в абсолютном этаноле может сильно изменить растворимость неполярных веществ.
 2018-01-21
2018-01-21 558
558








