Кислоты – молекулы или ионы, способные в данной реакции отдавать катион водорода
Кислота – донор протонов
Основания – молекулы или ионы, способные в данной реакции присоединять протоны (акцепторы протонов)
С каждой кислотой сопряжено основание, в которое она переходит, теряя протоны.
HCl + H2O = H3O+ + Cl-
H3O+ - катион гидроксония (Сопряженная кислота)
Каждой кислоте соответствует свое основание и каждому основанию - своя кислота. Эту пару сопряженных веществ называют кислотно-основной или протолитической парой. Каждый отдельный компонент этой пары называется протолитом. Кислота и основание одной протолитической пары называются сопряженными протолитами (сопряженными кислотой и основанием).
Для количественной оценки способности протона связываться с тем или иным основанием используют константы равновесия протолитических реакций.
Константа кислотности и константа основности сопряженного основания связаны друг с другом через константу автопротолиза растворителя.
Константа автопротолиза — физическая величина, характеризующая способность протонного растворителя к диссоциации. Обозначается KS.
|
|
|
Амфолиты (от греч. amphoteros — и тот и другой, lytos—растворимый) — амфотерные электролиты, т. е. вещества, молекулы которых содержат одновременно и кислотные, и основные группы, и поэтому в водных растворах диссоциируют и как кислоты с отщеплением водородных ионов Н +, и как основания с отщеплением гидроксильных ионов ОН-.
К амфолитам относятся биологически важные вещества: аминокислоты, пептиды, белки и др. Кислотные свойства этих веществ обусловлены наличием в них карбоксильных групп СООН, а основные свойства — содержанием аминогрупп NH2.
Теория Льюиса.
Льюис рассматривает кислотно-основное взаимодействие как образование донорно-акцепторной связи. Кислота - акцептор электронной пары, основание - донор электронов. Образуемое ими соединение - аддукт - является аналогом соли в традиционной концепции. Чем сильнее акцепторные свойства катиона, тем более сильной кислотой он является. Кислотные свойства катионов растут с увеличением их ионного потенциала, равного отношению заряда к радиусу: m = Z/R. Наиболее сильные кислоты - многозарядные катионы с малыми радиусами.
№18
Автопротолиз – обратимый процесс образования равного числа катионов и анионов из незаряженных молекул жидкого индивидуального вещества за счет передачи протона от одной молекулы к другой.
Наличие водородных связей в жидкой воде объясняет её автопротолиз
За счет тепловых колебаний атом водорода, образующий водородную связь, может на мгновение занять промежуточное положение между атомами кислорода. Из частицы с таким атомом водорода с равной вероятностью могут образоваться как исходные молекулы воды, связанные водородными связями, так и два иона: гидроксид-ион и ион оксония.
|
|
|
То есть, в воде протекает реакция 2Н2О = Н3О  + ОН
+ ОН  .
.
Также легко происходит и обратный процесс – образование двух молекул воды при столкновении иона оксония с гидроксид-ионом: Н3О  + ОН
+ ОН  = 2Н2О.
= 2Н2О.
Обе эти реакции протекают в воде постоянно и с равной скоростью, следовательно, в воде существует равновесие: 2Н2О AН3О  + ОН
+ ОН  .
.
Это равновесие называется равновесием автопротолиза воды.
Произведение K C· [H2O]2 – величина постоянная. Она называется константой автопротолиза воды (устаревшее название – ионное произведение воды) и обозначается 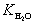 или К (Н2О).
или К (Н2О).
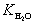 = [H3O = [H3O  ][OH ][OH  ] ] |
Как и константа равновесия, константа автопротолиза воды зависит от температуры. Экспериментально установлено, что при 25 °С константа автопротолиза воды
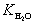 = 10–14 моль2/л2.
= 10–14 моль2/л2.
Отсюда следует, что при этих условиях в чистой воде
с (Н3О  ) = с (ОН
) = с (ОН  ) = 10–7 моль/л.
) = 10–7 моль/л.
При увеличении температуры значение константы автопротолиза воды несколько возрастает.
Такая низкая концентрация разноименно заряженных ионов в чистой воде объясняет, почему эта жидкость, хоть и плохо, но все же проводит электрический ток.
Для удобства оценки характера водной среды используют безразмерную величину водородный показатель.
pH=-lg[H+]
pOH=-lg[OH-]
Ионное произведение воды в логарифмической формуле pH+pOH =14
Кислотная среда: pH<7
Щелочная среда: pH>7
pH щелочи не может быть 1
 2018-01-21
2018-01-21 3959
3959
