Фтороводород
Газ с резким запахом, ядовит. Раствор HF в воде - слабая плавиковая кислота, что объясняется большой прочностью связи H-F и склонностью фтороводорода образовывать водородные связи. Плавиковую кислоту получают действием серной кислоты на плавиковый шпат. Она взаимодействует с активными металлами и обладает другими свойствами кислоты-неокислителя. Особенностью плавиковой кислоты является взаимодействие с кремнеземом, поэтому она растворяет стекло.
CaF2 + H2SO4 = 2HF + CaSO4
SiO2 + 4HF = SiF4 + 2H2O
Хлороводород. Соляная кислота
Бесцветный газ с резким запахом, на воздухе дымит, образуя с парами волы мельчайшие капли соляной кислоты. Связь H-Cl полярная ковалентная. В сухом виде HCl не имеет кислотных свойств, не проводит электрический ток, не взаимодействует с металлами и сухим аммиаком, сжиженный хлороводород не изменяют цвет индикаторов. Кислотные свойства появляются только в присутствии воды (хотя бы в виде паров). Водный раствор хлороводорода называется соляной кислотой
Кислота-неокислитель. Активные металлы вытесняют из соляной кислоты водород (окислитель ионы водорода), а малоактивные металлы с ней не взаимодействуют
Взаимодействует с основными оксидами и основаниями с образованием солей, как сильная кислота вытесняет слабые кислоты из их солей
Бромоводород
Газ по свойствам близкий к хлороводороду. Раствор в воде - бромоводородная кислота - более сильная, чем соляная кислота (α = 93,5%). Имеет свойства кислоты-неокислителя. Взаимодействует с активными металлами с выделением водорода, с основными оксидами и основаниями с образованием солей. Бромид серебра нерастворим. Более сильный восстановитель чем соляная кислота. Если из хлоридов концентрированная серная кислота только вытесняет хлороводород, то бромиды, как и саму кислоту, она окисляет
Иодоводород
Газ по свойствам близкий к хлороводороду и бромоводороду. Раствор его в воде - иодоводородная кислота - более сильная, чем HCl или HBr (α = 95%). Имеет свойства кислоты-неокислителя. Взаимодействует с активными металлами с выделением водорода, с основными оксидами и основаниями с образованием солей. Один из самых сильных восстановителей, окисляется до молекулярного иода
Галогени́ды (галоиды) — соединения галогенов с другими химическими элементами или радикалами. При этом галоген, входящий в соединение, должен быть электроотрицательным; так, оксид брома не является галогенидом.
По участвующему в соединении галогену галогениды также называются фторидами, хлоридами, бромидами, иодидами
В галогенидах галоген имеет отрицательную степень окисления, а элемент — положительную. Галогенидов не образуют Не, Ne и Аг.
По характеру связи элемент-галоген простые галогениды подразделяют на ионные и ковалентные.
Биологическая роль галогенов:
Фтор
В качестве микроэлемента фтор входит в состав всех организмов. У животных и человека фтор присутствует в костной ткани (у человека — 0,2-1,2%) и, особенно, в дентине и эмали зубов. В организме среднего человека (масса тела 70 кг) содержится 2,6 г фтора; суточная потребность составляет 2-3 мг и удовлетворяется, главным образом, с питьевой водой. Недостаток фтора приводит к кариесу зубов. Поэтому соединения фтора добавляют в зубные пасты, иногда вводят в состав питьевой воды. Избыток фтора в воде, однако, тоже вреден для здоровья. Он приводит к флюорозу — изменению структуры эмали и костной ткани, деформации костей. ПДК для содержания в воде фторид-ионов составляет 0,7 мг/л. ПДК газообразного фтора в воздухе 0,03 мг/м3. Роль фтора в растениях неясна.
Хлор
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия и регуляции водно-солевого обмена. Хлорные каналы представлены во многих типах клеток и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объема жидкости, участвуют в поддержании рН клеток. Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная - 0,09 %; в крови - 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе. Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений. HCl – желудочный сок.
Бром
Многие аспекты биологической роли брома в настоящее время еще не выяснены. В организме человека бром участвует в регуляции деятельности щитовидной железы, так как является конкурентным ингибитором иода. Соединения брома участвуют в деятельности клеток иммунной системы. Недостаток брома в пище приводит к бессоннице, замедлению роста и уменьшению числа эритроцитов в крови. Ежедневное поступление брома в организм человека с пищей составляет 2–6 мг. Особенно богаты бромом рыба, злаки и орехи. Железы внутренней секреции, гипофиз, восстанавливает равновесия процессов возбуждения и торможения.
Йод
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. У животных и человека йод входит в состав гормонов щитовидной железы — тироксина и трииодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма (особенно — на интенсивность основного обмена, окислительные процессы, теплопродукцию). В организме среднего человека (масса тела 70 кг) содержится 12-20 мг йода, суточная потребность составляет около 0,2 мг. Микроколичества йода жизненно необходимы человеку, дефицит йода в организме приводит к заболеванию щитовидной железы — эндемическому зобу, встречающемуся в местностях с низким содержанием йода в воздухе, почве, водах. Для того чтобы обеспечить поступление в организм необходимых количеств иода, используют йодированную поваренную соль. Процессы обмена вещества, щитовидная железа, способствует выработке гормонов.
Аналитические реакции:
1. NaCl + AgNO3 = AgCl↓ + NaNO3 (белый творожистый)
2. NaBr + AgNO3 = AgBr↓ + NaNO3 (бело-желтый)
3. NaI + AgNO3 = AgI↓ + NaNO3 (желтый)
4. 2KF + CaCl2 → 2KCl + CaF2↓ (белый)
№42
Титриметрический анализ (титрование) — метод количественного/массового анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки.
Анализ основан на точном измерении количества реактива, израсходованного на реакцию с определенным веществом. К раствору, приготовленному из навески анализируемого вещества, постепенно приливают раствор точно известной концентрации до тех пор, пока они полностью не прореагируют. На основании точного измерения объема реактива вычисляют содержание определенного вещества.
Химический эквивалент вещества – условная единица, соответствующая либо числу протонов (Н+), либо числу групп ОН, либо числу электронов (реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-основных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях).
Молярная концентрация эквивалента (нормальность) показывает, какое количество моль эквивалентов растворенного вещества содержится в 1 л раствора.
Молярную концентрацию эквивалента Сэк(В) находят как отношение количества эквивалентов вещества nэк(В) к объему раствора Vp
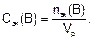
Закон эквивалентов: отношения масс, вступающих в химическое взаимодействие веществ, равны или кратны их химическим эквивалентам.
m1f1 = m2f2
Точка эквивалентности (конечная точка титрования) в титриметрическом анализе момент титрования, когда число эквивалентов добавляемого титранта эквивалентно или равно числу эквивалентов определяемого вещества в образце.
Фиксирование:
1. Индикаторы:
а)в кислотно-основном титровании - фенолфталеин, метилоранж, лакмус
б) в редоксиметрии - чаще всего крахмал (в илдометриии)
в) в комплексонометрии - эриохром черный, в осадительном - бихромат калия
2. физические показатели:
а) рН - с помощью рН-метра,
б)электропроводность - при кондуктометрическом титровании,
в)оптическая плотность - при фотоколориметрии
№43
Кислотно-основное титрование – титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации.
H3O + OH = 2H2O
Титрование раствором щелочи – алкалиметрия, раствором кислоты – ацидиметрия.
При количественном определении кислот рабочим раствором являются NaOH and KOH. При количественном определении щелочи – H2SO4 and HCl.
Если титровать раствор кислоты раствором щелочи, то происходит связывание ионов Н+ кислоты ионами ОН- и концентрация ионов Н+ постепенно уменьшается, рН раствора возрастает. При определении значения рН достигается точка эквивалентности и титрование должно быть закончено.
При титровании раствором щелочи связываются ионы ОН, концентрация ионов Н+ увеличивается и рН раствора уменьшается.
Индикатор - это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи ее.
Кислотно-основной индикатор сам является кислотой или основанием и при кислотно-основном титровании изменяет свою окраску в точке эквивалентности или вблизи ее.
В реакции нейтрализации при достижении точки эквивалентности происходит изменение значения рН раствора. Поэтому для фиксирования точки эквивалентности используют вещества – индикаторы, окраска которых меняется в зависимости от изменения рН.
| Индикатор | Интервал рН перехода | Изменение окраски |
| Метиловый оранжевый | 3,1—4,4 | оранжево - желтая |
| Метиловый красный | 4,2- 6,2 | красная - желтая |
| Фенолфталеин | 8,2—10,0 | Бесцветная - красная |
| Бромтимоловый синий | 6,0-7,6 | желтая- синяя |
 2018-01-21
2018-01-21 2409
2409
