1) Окраска индикатора должна быть интенсивной и различаться в кислой и щелочной среде.
2) Изменение окраски должно быть быстрым, четким и обратимым.
3) Окраска индикатора должна меняться в узком интервале изменения рН раствора.
4) Индикатор должен быть чувствительным и менять свою окраску в
присутствии минимального избытка кислоты или щелочи.
5) Индикатор должен быть стабильным, не разлагаться в водном растворе.
В процессе кислотно-основного титрования происходит изменение концентрации ионов водорода и соответственно рН раствора.
Графическое изображение зависимости рН от объёма добавляемого рабочего раствора (или от степени нейтрализации анализируемого раствора) называется кривой титрования.
Молярная концентрация эквивалента (нормальность) показывает, какое количество моль эквивалентов растворенного вещества содержится в 1 л раствора.
Молярную концентрацию эквивалента Сэк(В) находят как отношение количества эквивалентов вещества n эк(В) к объему раствора Vp
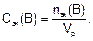
Размерность молярной концентрации эквивалента: моль•л.
Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора.
Рассчитывается по формуле:
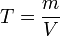
где
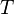 — титр раствора (в г/мл)
— титр раствора (в г/мл)
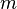 — масса растворённого вещества (в г)
— масса растворённого вещества (в г)
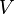 — объём раствора (в мл)
— объём раствора (в мл)
№44
Оксидиметрия – титриметрические методы в аналитической химии, основанные на реакциях окисления – восстановления. В процессе титрования меняется ОВ потенциал системы, вблизи точки эквивалентности наблюдается изменение потенциала. К оксидиметрии относятся перманганатометрия, цериметрия, хроматометрия, иодометрия.
Перманганатометрия — это титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления с участием перманганат-ионов.
В основе перманганатометрического титрования лежит окислительно-восстановительный процесс с участием пары Mn(VII)/Mn(II) в кислой среде:
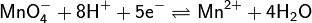
В качестве рабочих растворов (титрантов) в оксидиметрии применяют растворы окислителей и восстановителей.
Окисление проводят в сильнокислой среде, в которой MnO4ˉ проявляет сильные окислительные свойства. Продуктом восстановления KМnO4 в кислой среде является почти бесцветный ион Mn2+:
MnO4‾ + 8 H+ + 5 ē → Mn2+ + 4 H2O,
что удобно для фиксирования точки эквивалентности. При титровании розовая окраска иона MnO4ˉ становится заметной от одной избыточной капли рабочего раствора KMnO4, поэтому никакого специального индикатора не требуется (безиндикаторное титрование).
создания сильнокислой среды пользуются растворами H2SO4. Рабочий раствор KМnO4 готовят заранее, оставляют его на несколько дней до полного осаждения Mn2+. В качестве стандартных веществ для установления титра раствора KМnO4 используют дигидрат щавелевой кислоты Н2С2О4·2Н2О или безводный оксалат натрия Nа2С2О4.
Калия перманганат в сильнокислой среде количественно восстанавливается щавелевой кислотой:
2 KМnO4 + 5 H2C2O4 + 3 H2SO4 = 2 MnSO4 + K2SO4 + 10 CO2 + 8 H2O
№45
Иодометрия — титриметрический (объёмный) метод определения веществ, основанный на реакциях окисления-восстановления (разновидность оксидиметрии) с участием иода или иодида калия
Прямое иодометрическое титрование непосредственно раствором I2 может быть использовано, в частности, для титрования восстановителей в присутствии избытка KI:
Этим способом определяют концентрацию As(III), Sn(II), Sb(III), сульфидов, сульфитов, тиосульфатов и др.:
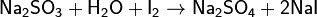
Возможно также определение восстановителей с избытком иода, непрореагировавшее количество которого определяется титрованием тиосульфата натрия.
2 Na2S2O3 + I2 → Na2S4O6 + 2 NaI
Косвенное иодометрическое титрование используется для титрования окислителей; в этом случае определяемые вещества взаимодействуют с избытком KI с образованием иода, который оттитровывается раствором тиосульфата натрия. Этот способ используется для определения концентрации Cu(II), H2O2, Br2, BrO3-, ClO-
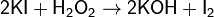
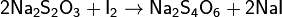
Растворимость йода в воде невелика (около 0,2 г/л или при-мерно 1 * 10"3 моль/л), поэтому его титрованные растворы готовят растворением точной навески свободного йода в концентрированном растворе KI.
Для достаточно концентрированных неокрашенных растворов индикатор не нужен - иод же сам по себе их окрашивает.
В случае сильно разбавленных растворов используется крахмал - синее окрашивание.
 2018-01-21
2018-01-21 311
311







