Правило Клечковского: порядок заполнения энергетического состояния определяется стремлением атома к минимальному значению суммы главного и орбитального квантовых чисел. E=min при n+l=min, если сумма главного и орбитального квантовых чисел равна, то должно быть минимальным главное квантовое число: E=min при n=min, если n+l=const. В соответствии с этим правилом энергетические подуровни заполняются в следующем порядке: 1s2<2s2<2p6<3s2<3p6<4s2<3d10<4p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10<7p6. (пример: е строение Галлия(Ga) 31Ga 1S^2 2S^2 2P^6)
Принцип Паули (Графическое строение атома): данный принцип состоит в том, что в атоме не может быть электронов, имеющих одинаковый набор всех 4х квантовых чисел. Из принципа Паули следует, что каждая орбиталь не может быть занята более чем двумя электронами с противоположными спинами.
Два электрона, спины которых имеют противоположные знаки, находящиеся на одной орбитали называются спаренными, в противном случае - неспаренными.
Правило Хунда: электроны располагаются на энергетических орбиталях так, чтобы их суммарный спин был максимальным.
- Периодический закон Д.И.Менделеева. Периодическая таблица элементов Д.И.Менделеева.
Между всеми химическими элементами существует связь, объединяющая их в одно единое целое. Если расположить все элементы в порядке возрастания их атомных масс, то можно заметить, что сходные в химическом отношении элементы встречаются через правильные интервалы, и что в ряду элементов многи их свойства периодически повторяются. Эту закономерность выражена в периодическом законе, сформулированном Д.И. Менделеевом:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов. Если проследить изменение свойств элементов, стоящих в периодической таблице, то можно заметить, что изменение свойств химических элементов не совершается непрерывно в одном и том же направлении, а имеет периодический характер. Через определенное число элементов происходит как бы возврат назад к исходным свойствам, после чего они вновь повторяют свойства предыдущих элементов в той же последовательности, но с некоторыми качественными и количественными различиями. Ряды элементов, в пределах которых свойства изменяются последовательно Менделеев назвал периодами. Разделив все элементы по периодам, и расположив периоды один под другим, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам. Она состоит из восьми вертикальных столбцов и десяти горизонтальных рядов.
В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 21 элемент. Каждый период, за исключением первого” начинается щелочным металлом и заканчивается благородным газом (7-й период — незаконченный).Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами.
- Химическая связь. Виды химической связи. Основные характеристики химической связи.
Химическая связь – это взаимодействие двух или более атомов, приводящее к образованию устойчивой многоатомной системы. Условием образования хим связи является понижение потенц эн-и системы взаимодейств атомов в составе молекулы иона или свободного радикала по сравнению с суммой потенц эн-й изолированных атомов. Химическая связь образуется, если электроны взаимодействующих атомов получают возможность двигаться одновременно вблизи положительных зарядов нескольких ядер. Важнейшими видами хим связи являются: ковалентная (полярная, неполярная, обменная и донорно-акцепторная), ионная, водородная, металлическая.
Основные характеристики химической связи: кратность связи, длина, прочность, насыщаемость, направленность, полярность.
Энергия связи (ЕСВ) – минимальная энергия, необходимая для разрушения связи.
Измеряется в электронвольтах (эВ) для одной связи или в кДж/моль для одного моля связей. Энергия связи является характеристикой прочности связи – чем выше энергия связи, тем прочнее связь.
Длина связи (LСВ)– расстояние между ядрами связанных атомов. Измеряется в нанометрах (нм) или в ангстремах (А). Чем короче связь, тем она, как правило, прочнее.
Насыщаемость связи – способность атомов участвовать в образовании ограниченного числа ковалентных связей
Число связей между атомами в методе валентных связей называется кратностью связи.
Прочность - кол-во эн-и необходимое для её разрыва
Направленность связи – если в пространстве существуют определенные направления, вдоль которых распространяется действие связи, то связь направлена, если таких направлений нет – то ненаправлена. Валентные углы к-е образуются между хим связями при образовании молекул
Полярность – дипольный момент молекулы
Энергия и длина связи характерны для любой химической связи, насыщаемость и направленность зависят от вида связи.
- Ковалентная связь. Метод валентных связей. Механизмы образования ковалентной связи. Свойства ковалентной связи.
Ковалентная связь – это химическая связь между двумя атомами, осуществляемая общей для этих атомов парой электронов (H2, Cl2). Существует два подхода квантового механического описания ковалентной связи: метод валентной связи и метод молекулярных орбиталей.
В основе метода валентных связей лежат следующие положения:
- ковалентная химическая связь образуется двумя электронами, обладающими противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
- ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующим электронным облаком.
МВС позволяет различать два механизма образования ковалентной связи: 1)обменный(за счёт образования общей е пары) и 2)донорно-акцепторный (связь образуется за счет неподеленной электронной пары одного атома-донора и свободной орбитали другого атома).
Свойства ковалентной связи: 1) полярность (ковалентные связи бывают полярные(образ из 2 и более различных атомов. е пара сдвинута в сторону более электроиотриц атома(HCl, NH3, SO2, H2SO4) и неполярные(молекула образована из 2 одинак атомов)), 2) направленность (свойство направлять, а) по характеру перекрывающей связи (хим связь, образ перекрыванием атомных орбиталей вдоль прямой линии, проведенных через ядра взаимод атомов, называется сигма-связью между 2 атомами- 1 сигма-связь, они наход под опрде углом др к др; при перекрывании атомных орбиталей расположенных перпендикулярно и параллельно образуются пи-связи)),б) по распределению в пространстве (молекула может иметь линейную, угловую, треугол, Т-образ, пирамидальную и др структуры) в) гибридизация -модификация атомных орбиталей(при обр хим св происходит изм валентных орбиталей атома. Исходные ат орбит при перемешивании образуют более энергетич выгодные орбитали. Происходит перераспред-е электр плотности. В рез-те электр облако вытягиваетсяк взаимод атому, увелич его перекрыв-е с эл облаком последнего. Число гибридных атом орбит = числу участв в гибридизации исход ат орбит))
- Ионная связь. Процесс образования ионной связи. Свойства ионной связи.
Ионная связь – это химическая связь, возникающая между ионами в результате действия электростатических сил.
Процесс образования иона состоит из двух этапов:
1) образование иона из двух взаимодействующих атомов
K 0 – e = K +;Na 0 – e = Na +
A0 + e = A; Cl 0 + e = Cl -
2) образование молекулы за счет электростатического притяжения образовавшихся ионов
K+ + A-=KA
Na 0 – e = Na + Na+Cl=NaCl
Cl 0 + e = Cl-
Ионы могут быть простыми и сложными. Ионная связ ненаправлена и ненасыщенна.
1)склонность к ассоциации (соединение друг с другом, либо с другими молекулами);
2)все ионные соединения обладают кристаллической решеткой;
3)кристалл ионного соединения можно рассматривать как единую молекулу, поскольку все связи между ионами могут быть равноценными;
4)поляризуемость иона (способность иона деформироваться под действием внешнего электрического поля).особенности поляризуемости ионов: а) при одинаковом абсолютном значении заряда и равных радиусах ионов поляризуемость анионо больше чем у катионов. б) поляриз ионов с аналогичным электронным строением увелич с ростом ионного радиуса
F-<Cl-<Br-<I-; Li+<Na+<K+<Rb+<Cs+
5) поляриз действие ионов – способность иона деформировать(поляриз) др ион. Чем больше заряд иона, тем сильнее создаваемое им элекр поле, тем больше поляриз способность его взаимодействовать на др ионы. Na+<< Al +3
10. Водородная связь.
Водородная связь характерна для атома водорода, связанного непосредственно с наиболее электроотрицательным элементом.
Например, в молекуле воды е связь сильно смещена к атому О, к-й понижает характер-ся высокой электроотриц.в рез-те чего О преобр частично отриц зарад, а Н частично положитю Между атомами Н и О соединения молекулы возникает электростатич притяжение, что приводит к образ-ю водородной связи.
Водородная связь может быть двух типов:
1)межмолекулярная водородная связь
2)внутримолекулярная водородная связь (характеристика для белков, кислот, эфиров).
В результате появления водородной связи может происходить ассоциация молекул и связывания их димеры, триммеры и т.д., что приводит к некоторому изменению физических свойств веществ.
11. Металлическая связь.
Металлическая связь – это химическая связь, которая проявляется при воздействии атомов электронов, имеющих избыток свободных валентных орбиталей по отношению к числу валентных электронов. При сближении таких атомов валентные электроны приобретают способность свободно перемещаться между ядрами в объеме кристалла. Характерна для металлов, сплавов.
Свойства металлической связи: проводимость (незаполненные энергетические уровни), теплопроводность (свободное перемещение электронов), пластичность, непрозрачность, металлический блеск(в рез-те испускания света при возвращении возбужд светом е на более низкие эн-е уровни.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
12. Растворы. Понятие растворимости. Способы выражения содержания растворенного вещества в растворе.
Раствор – гомогенная(однородная) система, состоящая из двух и более компонентов, количества которых могут меняться в широких пределах.
Растворы бывают: газообразные (воздух), жидкие (вода,спиртовые растворы), твердые (сплавы металлов).
Компоненты жидкого раствора условно подразделяются на рстворитель и растворенное вещество.
Растворитель – компонент, в к-м растворено, например, твердое вещество или в случае обр-я раствора из 2 жидкостей, то раст-ль в большем кол-ве. Если раствор из 2 жид 1:1, то растворитель в более чистом виде. раствор находящийся в равновесии с раствор вещ-ом – насыщенный. Ненасыщенный – р-р, содерж меньше раствор в-ва, чем его насыщенный р-р при данной t.
Концентрированный раствор – раствор с высоким содержанием растворенного вещества.
Разбавленный – с низким содержанием растворенного вещества.
Растворимость – способность вещества растворяться в растворителе. Мерой растворимости в-ва служит его содержание в насыщенно растворе P= mв-ва/Vр-ля [г/л].
Растворимость вещ-в в воде:
- если 100 г воды растворяется 10 г в-ва – хорошо р
- если р-р менее 1 г в-ва – мало з
- если р-р менее 0,01 г в-ва - нераствор
Растворимость вещ-ва зависит от природы раствор в-ва, от природы р-ля, от t, от Р.
Растворимость газов прямо пропорц его Р над жид х=к*р – Ур-е Генри
Способы выражения содержания растворенного вещества в растворе:
- массовая концентрация ω=(m (раств в-ва)/m (р-ра))*100%, m(р-ра)=V*ро, m(р-ра)=m(в-ва) + m(р-ля)
- объемная концентрация x=(Vв-ва/Vр-ра)*100%
- молярная (мольная) доля N=(ν раств в-ва/ ∑νi)*100%
- молярная концентрация (молярность) Cм=(m в-ва/ M)(1000/Vр-ра), V в мл, [моль/л]
- моляльная концентрация (моляльность) Cm=(m в-ва/M)(1000/m р-ля), [моль/кг]
- нормальная концентрация (нормальность; эквивалентная концентрация) Сн=(m (в-ва)/ mэ)(1000/Vр-ра), [г/мл]
- титр T=m(в-ва)/V (р-ра) [г/мл]
При равенстве масс в-ва, в р-рах различных по концентрации и способам её выражения справедливо:
m(в-ва)= (ω*ро*V)/ 100% = (Cм*М*V)/ 1000 = (Сн*mэ*V)/1000
13. Осмос. Осмотическое давление. Законы Рауля и Вант-Гоффа.
Раствор – гомогенная среда, в к-й частицы раствор в-ва находятся в беспорядоченном тепловом движении и равномерно распред по всему V р-ра.
Встречная(двухсторонняя) диффузия – это самопроизвол процесс перемещения р-ля и раствор в-ва в противоположн направлениях.
Осмос (односторонняя диффузия) – переход растворителя из менее концентрированного раствора в более концентрированный раствор.
Осмотическое давление – гидростатическое давление, равное разности уровней I и II. Величина осмотического давления зависит от концентрации раствора, от его температуры и не зависит от природы растворенного в-ва и растворителя.
Уравнение Вант-Гоффа: Pосм=CMRT. CM – молярная концентрация, давление измеряется в кПа.
I закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного в-ва: (P0-P)/P0=Ni,
Ni – молярная доля.
Понижение t замерзания р-ра определяется как разность замерз-я чистого р-ля и t замерзания р-ра: Δtз=tз,0 – tз, повышение t кипения р-ра: Δtк – tк,0
2 закон Рауля: Δtк=Эт*Сm, Сm-моляльная концентрация, Эт-эбулиоскопическая постоянная
Δtз=Кт*Сm, Кт – криоскопическая постоянная.
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов.
14. Растворы электролитов. Теория электролитической диссоциации. Степень диссоциации. Закон разбавления Оствальда.
Электролит – раствор в-ва, проводящий электрический ток.
Изучая особенности р-ров, Аррениус и Менделеев создали Теорию электролитической диссоциации (ТЭД). Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительные и отрицательные ионы(катионы и анионы). При этом ионы в растворе всегда находятся в состоянии неупорядоченного теплового движения.
Процесс распада на ионы:
NaOH ↔ Na+ + OH-
H2SO4 ↔2H+ + SO4(2-)
1 этап: Н2SO4 ↔H+ + HSO4 –
2 этап: HSO4 ↔ H+ +SO4 (2-)
В зависимости от структуры растворяющегося в-ва диссоциация может протекать по-разному. Типичны 2 случая:
1) диссоциация солей (ион-дипольная)
2) диссоциация кислот (диполь-дипольное)
В рез-те диполь-дипольного взаимод-я ион Н оказыв прочно связан с молекулой Н2О в ион гидроксония: НCl + H2O = H3O+ + Cl-
Процесс взаимод-я ионов с полярными молекулами р-ля называется сольватацией, а ионы – сольватами.
При диссоциации распадается только часть электролита на ионы. Сила электролита определяется степенью ЭД: α=CM молекул/СM в-ва
CM молекул – которые продиссоциировали.
В зависимости от степени ЭД электролиты делятся на
1)сильные (α=30%)(NaOH, KOH, все основ, 1 группа, H2NO3, H2SO4,HCL,гидрогалагены: HBr,HCl,HI,соли: NaCl, KCl и др
2)средние (α=3-30%)(HF-плавиковая кислота, H3PO4, H2SO3,HCOOH)
3)слабые (α<3%) (все оставшиесяБ из орг к-лот CH3COOH
α влияет на концентрацию р-ра и t
Для слабых электролитов связь между концентрацией и степенью его диссоциации выражает Закон разбавления Оствальда: K=(CMα2)/(1-α)
K – константа диссоциации, α – степень диссоциации, См – молярная концентрация
15. Произведение растворимости. Водородный показатель.
При растворении ТВ тела в воде, процесс растворения прекращается, когда получается насыщенный р-р, в котором устанавливается гетерогенное равновесие между твердой фазой и перешедшими в раствор ионами. Например:
CaSO4 (т)  Ca2+ + SO42–
Ca2+ + SO42–
Kравнов= ([Ca2+][SO42–])/[CaSO4] – const
В насыщенном растворе твердого электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Она называется произведением растворимости.
Kравнов CaSO4= [Ca2+][SO42–]=ПР (произведение растворимости)
АmВn  mА+ + nВ–
mА+ + nВ–
ПР (Am Bn)=[A+]^m[B–]^n
Чем меньше значения ПР электролита, тем легче выпадает осадок и тем труднее он растворяется. При повыш-и t зн-е ПР увеличивается.
Водородный показатель (рН) — величина, характеризующая активность или концентрацию ионов водорода в растворах.
pH= –lg [H+]
H2O  H+ + OH–
H+ + OH–
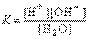 =Кравн=1,8 * 10^-6
=Кравн=1,8 * 10^-6
Принимая К воды сонст, то Кравн [H2O]=К(H2O)= [H+][OH–]
В чистой воде (дистиллированной) при t=25 С, К(H2O)= [H+][OH–]=10^-14
pK=-lg К(H2O)=14
р-ры в к-х концентрация [H+]=[OH–]=10^-7 называются нейтральными
pH=-lg[H+]=7 – водородный показатель
pOH=-lg[OH–]=7
Если рН<7, то такие р-ры кислотные рОН>7
Если pH>7, то такие р-ры щелочные рОН<7
16. Гидролиз солей.
Гидролиз – это взаимодействие вещ-в с водой, при котором составные части вещ-ва соед-ся с составными частями воды.
Одним из признаков протекания гидролиза является изменение рН среды раствора.
4 случая гидролиза солей:
1)соль образована сильной к-той и сильным основанием, гидролиз не протекает, рН остается нейтральным:
NaCl+HOH ↔NaOH+HCl
Na+ +Cl- + HOH ↔Na+ +OH- + Cl- +H+
HOH ↔OH- + H+, pH=7
2)соль образована сильной кислотой и слабым основанием (NH4NO3, AlCl3, Fe2(SO4)3)
NH4Cl + HOH ↔ NH4OH + HCl
Na+ + Cl- + HOH ↔ NH4+ + OH- + H+ + Cl-
NH4+ + HOH ↔ NH4OH + H+, pH<7
3)Соль образована слабой кислотой и сильным основанием (CH3COONa, KCN, Na2CO3).
NaCN + HOH ↔ NaOH + HCN
Na+ + CN- + HOH ↔ Na+ + OH- + HCN
CN- + HOH ↔ OH- + HCN, pH>7
4) Соль образована слабой кислотой и слабым основанием (CH3COONH4, (NH4)2CO3).
NH4CN+HOH ↔ NH4OH + HCN (сильная к-та)
NH4+ + CN- + HOH ↔ NH4OH + HCN, pH = 6/8
Количество ступеней гидролиза зависит от валентности элементов.
1)CuCl2+HOH ↔Cu0HCl + HCl
Cu(2+)+2Cl(-)+HOH ↔ CuOH(+) + Cl(-) + H(+) + Cl(-)
Cu(2+) + HOH ↔ CuOH + H(+), pH < 7
2) CuOHCl + HOH ↔ Cu(OH)2 + HCl
CuOH + Cl(-) + HOH ↔ Cu(OH)2 + H(+) +Cl(-)
CuOH(+) + HOH ↔ Cu(OH)2 + H(+), pH <7
Доли в-ва, подвергшиеся гидролизу называют степенью гидролиза и зависит от сонст равновесия гидролиза, так же от t и концентрации соли.
NH4CN+HOH ↔ NH4OH + HCN
Кравн= ([NH4OH][HCN])/([NH4CN][H2O]
К равн[H2O]=Kr(([NH4OH][HCN])/([NH4CN)
K[H2O] - const
Чем больше конст гидролиза, тем в большей степени протекает гидролиз.
Для солей, образованных слабой кислотой и сильным основанием конст гидролиза связана с константой кислотности так:
Kr=(K[H2O])/Kк
Для солей, образованных слабым основанием и сильной кислотой так:
Kr=(K[H2O])/Kосн
Для солей, образ слабой к-той и слабым осн:
Kr=(K[H2O])/(Kк*Косн)
Процесс гидролиза всегда эндотермический(при поглощении Q)
17. Химическая термодинамика. Энергетика химических реакций. Стандартные термодинамические величины.
Химическая термодинамика – это наука, изучающая превращения одних видов энергии и работы в другие химические превращения.
В качестве ТД-х параметров в химич ТД используют: давление в Па, объём в м^3, теплоёмкость.
Набор параметров определяет сост-е системы. Системой называется тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее.
В хим ТД исользуют след-е процессы: изохорный(V-const), изобраный(P-const),адиабатный(Q=0), изотермический(T=const), изохороизобарный
Хим реакции протекают с выделением или поглащением энергии. Она поглащ/ выделяется в виде тепла.
В любом процессе соблюдается закон сохранения энергии: ∆U= ∆Q- ∆A
Это соотношение называется первым началом термодинамики и означает, что если к системе подводится теплота Q, то она расходуется на изменение внутренней энергии Δ U и на совершение работы A.
Согласно 1 Н ТД изм-е внут эн-и не зависит от способа проведения процесса, а опред-ся только начальным и конечным сост-ем системя.
Работа обычно совершается при расширении системы против внешнего давления и при постоянном давлении равна A = P Δ V. Поэтому первое начало термодинамики можно записать в виде: 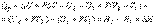 Величина H = U + PV называется энтальпией. энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Величина H = U + PV называется энтальпией. энтальпия - это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Реакции, протекающие с выделением эн-и – экзотермически (∆H<0, ∆Q>0), а с поглащением – эндотермические(∆Н>0)
Термодинамическими величинами (изменение энтальпии, энтропии и энергии Гиббса при образовании, мольная теплоёмкость) называют физические величины, применяемые при описании состояний и процессов в термодинамических системах. Термодинамика рассматривает эти величины как некоторые макроскопические параметры и функции, присущие системе, но не связанные с её микроскопическим устройством.
18. Закон Гесса и его следствие. Химико-термодинамические расчеты.
Энергия, которая выделяется и поглощается, называется тепловым эффектом химической реакции.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит от начального и конечного состояния исходных веществ и продуктов реакции и не зависит от промежуточных стадий. Δ H =Δ H 1+Δ H 2.
CH4+2O2=CO2 + 2H2O -Δ H
1) CH4=C+2H2 - Δ H 1
2) C+O2=CO2 - Δ H 2
3) 2H2+O2=2H2O – Δ H 3
Δ H =Δ H 1+Δ H 2+ Δ H 3
Следствие из закона Гесса:
1) стандартный тепловой эффект химической реакции равен суме станд теплот образования продуктов реакции за вычетом суммы станд теплот образования исходных веществ с учётом стехометрических коэф в ур-и реакций.
Δ H 298 = ∑(ν * Δ Hf,298)пр + ∑(ν *Δ Hf,298)исход [Дж/моль]
2) стандартный тепловой эффект химической реакции равен суме станд теплот сгорания исходных веществ за вычетом суммы станд теплот сгорания исходных веществ с учётом стехометрических коэф в ур-и реакций.
Δ H 298 = ∑(ν * Δ сгор,298)исход + ∑(ν *Δ Hf,298)пр
Большая часть хим процессов протекает в условиях отличн от станд, поэтому прибегают к расчету тепл эф-ов реакции в реальных условиях с помощью Ур-й Киргофа
Часто возникает необходимость установить ТД вероятность данного процесса и направл-я течения. Для хар-ки данного сост-я системы пользуются величиной энтропии S.
Энтропия- это ТД вероятность данного сост-я системы:dS=dQ/T
Если процесс протекает в Р-конст и Т-конст, то dQ=dH, dS= ∆H/T
Изм-е энтрапии из закона Гесса:
∆S 298 = ∑(ν * Δ S298,j)пр + ∑(ν *Δ S298,i)исход
Критерием возможности самопроизвольного протекания реакции явл-ся изобарно-изотермический потенциал, Энергия Гиббса(G)
Δ G 298 = ∑(ν * Δ Gf,298)пр + ∑(ν *Δ Gf,298)исход
G=H-TS
Чем меньше энергия Гиббса, тем легче протекает процесс в напр целевых продуктов. Если эн-я Гиббса больше 0, то обратный процесс протекает в сторону образ-я исход в-в. Если эн-я Гиббса = 0, то процесс находится в ТД равновесии.
19. Кинетика химических реакций. Скорость химической реакции. Факторы, влияющие на скорость реакции.
Кинетика – раздел химии, который изучает скорость химических реакций. Скорость химической реакции измеряется количеством в-ва, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единицу площади поверхности раздела фаз (для гетерогенной реакции) с учетом стехиометрических коэффициентов.
Гомогенной называется система, состоящая из одной фазы. Гетерогенной — система, состоящая из нескольких фаз. Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства системы изменяются скачком. Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Если реакция протекает между веществами, образующими гетерогенную систему, то она может идти только на поверхности раздела фаз, образующих систему.
Для гомогенной реакции: υ=±1/ν*1/V*dni/dτ, где υ – скорость, ν-стехиометрический коэф, ni-кол-во молей вещ-ва, V-объём системы, τ –время, S-площадь пов-ти раздела фаз
Для гетерогенной реакции: υ=±1/ν*1/S*dni/dτ
(+ относится к продуктам реакции, - к исходным вещ-вам)
Ci=(dni)/V следовательно υ=±1/ν*dСi/dτ
На скорость рекции влияют 3 фактора: 1)природа и концентрация реагирующего в-ва; 2)температура; 3)давление. Дополнительные факторы: частота реагентов, катализатор, среда, форма сосуда, интенсивность перемешивания, добавление исход в-в в р-р, ультрафиолет излучение.
Если реакция протекает в рез-те непосредственного превращения молекул исходного вещ-ва в молекулы продуктов реакции, то такая реакция элементраная или простая.
Боьшинство реакция вклюдчает несколько стадий и протекать в различных направлениях: обратимо, параллельно, послед-но, сопряжено, послед-паралл} сложные. (пример: A →B →C, A ↔B) В сложных реакциях только 1 главная, остальные-побочные. В сложных реак-ях скорость образования конечных продуктов реак-й часто зависит от скорости лишь1-й наиболее медленно протекающей. Совокупность элементарных хим.реакций опред.механизмом хим.реакций.
20. Зависимость скорости реакции от природы и концентрации реагирующих веществ. Закон действия масс. Порядок реакции.
Влияние природы реагирующих в-в определяется их атомным составом, пространственным строением и свойствами. Скорость реакции определяется скоростью разрыва одних и образования других химических связей.
По числу взаимод в реакции молекул определяют молекулярность реакции:Е в реакции участвет 1 вещ-во(A→В – мономолек-я), если 2 в-ва, то (бимолек-я), если 3 в-ва, то тримолек-я. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц, зависимость скорости реакции от концентрации определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих в-в.
A+B→C+D υ=k[A][B], где k– коэф пропорц-ти, const скорости реакции) aA+bB→cC+dD υ=kC(A)^aC(B)^b
Если все в-ва наход-ся в газовой фазе, то скор хим.реакции: υ=kР(A)^aР(B)^b, где Р – парциальное давление в-ва, Р(А)=(а/(а+в))*Ратм(пример: 3H2+N2 ↔2NH3, υ1=k1C(H2)^3 * C(N2), υ2=k2C(NH3)^2)
При гетерогенных реакциях конц-я вещ-в, наход-ся в тв.фазе обычно не изм-ся в ходе реакции, поэтому она не включают в Ур-е з-н действия масс.
СаСО3 → СаО + СО2, υ= kС(СаСО3)= k’
В ур-ях скор.реакции конц-я каждого из реагирующих вещ-в входит в выражение степени, равной стехиометрический коэф. Этот показатель-порядок реакции.Различают частный и общий порядок реакции. Частный порядок n –показатель степени, в к-м конц-я в-ва входит в кинетическое ур-е: υ= kС(А)^2C(B), n(A)=2, n(B)=1. Общий порядок реакции –сумма частных порядков:n=n(A)+ n(B)=3
C учётом порядка реакции общее ур-е скорости реакции:: υ= k∏Сi^n
Порядок простой реакции равен числу молекул, участвующих в элементарной стадии. Он всегда принимает целые и положительные значения. Если сложная реакция представляет ряд последовательных стадий, из которых 1 стадия лимитирующая, то порядок суммарной реакции всегда равен порядку лимитирующей стадии. Порядок сложной реакции чаще всего определяется экспериментально и в этом случае порядок может принимать целые, дробные, положительные, отрицательные, нулевые значения.
Величина k зависит от природы реагир в-ва, от t, от катализаторов, от конц в-ва НЕ ЗАВИСИТ. Для реакции 1 порядка: k=(1/τ)*ln(Co/Co-Cn), Cn-концентрация продукта, Co-начальная конц-я. Для любого порядка k=(1/τ*(С1,о-С2,о))*ln[C2(С1,о-Сn)]/[C1(C2,o-Cn)]
21. Зависимость скорости реакции от температуры. Температурный коэффициент. Правило Вант-Гоффа.
Скорость химической реакции увеличивается с ростом температуры. Это возрастание принято характеризовать температурным коэффициентом скорости реакции – γ. Это число, которое показывает, во сколько раз возрастает скорость реакции при повышении температуры на 10°С. Зависимость скорости реакции от температуры может быть выражена уравнением Вант-Гоффа. υ2/υ1= k2/k1=γΔt/10,
где v 1 – скорость при температуре t 1; v 2 – скорость при температуре t 2. Для большинства реакций температурный коэффициент γ лежит в пределах от 2 до 4.
Если скорость реакции увеличивается при повышении t в рез-те того,что элемент-е зим.реакция протекает не при всяком столкновении реагируемых вещ-в, а реагируют только те молекулы, к-е обладают достаточной энергией, чтобы разорвать или ослабить хим.связи в исход частицах и тем самым создают возможность образования новых молекул. Каждая хим.реакция обладает своим энергетич барьером. Для его преодоления необходимы некоторые избыточная эн-я. Эта эг-я – эн-я активации. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации. Если эн-я активации очень мала(<40кДж/моль), то часть столкновений между частицами реагирующих в-в приводит к образованию продуктов реакции. Скорость таких реакций очень велика. Если энг-я актив-и(>120 кДж/моль), то очень малая часть столкновений взаимодействующих частиц приводит к протеканию хим.реакций, у таких реакций скорость очень мала. Если эн-я актив-и(от 40-120 кДж/моль), то такая реакция не очень быстро и не очень медленно.Чкорость такой реакции можно изучить измерив. Зависимость константы скорости реакции от t, от эн-и активации выр-ся уравнением Аррениуса:
где A – предэкспоненциальный множитель, зависящий только от природы реагирующих веществ; Ea – энергия активации, представляющая собой высоту энергетического барьера, разделяющего исходные вещества и продукты реакции (см. рисунок 2.1); R – универсальная газовая постоянная; T – абсолютная температура.
22. Химическое равновесие. Смещение химического равновесия. Принцип Ле Шателье.
При протекании обратимых реакций в какой-то момент времени скорость прямой и обратной реакции столкновения одинаковы наступает хим.равновесие.
aA + bB ↔ cC + dD, υ1=k1C(A)^aC(B)^b, υ2=k2C(C)^c C(D)^d, υ1=υ2.
В момент хим.равновесия: Кр=k1/k2=[ C(C)^c C(D)^d]/[C(A)^aC(B)^b], где С – равновесные концентрации.
Константы равновесия хим.реакции связаны со стандартным изм-ем энергии Гиббса так: ∆Gr=-RTlnKравн, ∆Gr=-2,3RTlgKравн, lnKравн= -∆Gr/RT
Если система находится в состоянии равновесия, то она будет пребывать в нём до тех пор, пока внешние условия сохраняются постоянными. При изменении условий система выйдет из равновесия, но через некоторое время установится новое хим.равновесие отличное от предыдущего.Процесс перехода от одного хим.равновесия к другому называется смещение хим.равновесия. Направление этого смещения подчиняется принципу Ле Шателье.: если на систему, находящуюся в равновесии оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанные воздействия уменьшатся. На смещение равновесия оказывает влияние: 1) температура: при повышении t, равновесие смещается в сторону эндотермической реакции, а понижение t, равновесие смещается в сторону экзотермической реакции. 2) давление: при повышении давления равновесие реакции смещается в направлении изменении общего числа молей в-в, понижение давления способствует процессу, сопровождающемуся увеличением объема. Если реакция протекает без изменения объема, то изменение давления в системе не оказывает влияниена химическое равновесие. 3) концентрация: увеличение концентрации исходных веществ приводит к увеличению скорости прямой реакции, при этом протекающий в системе процесс завершится, когда скорости прямой и обратной реакций станут равны и установится новое равновесие. Уменьшение концентрации приводит к смещению равновесия в сторону его образования.
23. Степень окисления элементов. Основные типы окислительно-восстановительных реакций. Составление окислительно-восстановительных реакций.
Степень оксиления- это условный зарад атома в молекуле, вычисленный в преположении, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью - положительные.
Например: N2H4 (гидразин)
H H
N-N
H H
степень окисления азота - -2; валентность азота - 3.
Расчет степени окисления:
1.Степени окисления атомов в простых веществах равны нулю (Na0; H20).
2. Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
3. Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу -O-O-, в которой степень окисления кислорода -1).
4. Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры: V2+5O5-2; Na2+1B4+3O7-2; K+1Cl+7O4-2; N-3H3+1; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2
Существует два типа химических реакций:
A Реакции, в которых не изменяется степень окисления элементов:
Реакции присоединения SO2 + Na2O = Na2SO3
Реакции разложения Cu(OH)2 -t°= CuO + H2O
Реакции обмена AgNO3 + KCl = AgCl¯ + KNO3
B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений: 2Mg0 + O20 = 2Mg+2O-2 2KCl+5O3-2 -t°= 2KCl-1 + 3O20
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление— это процесс отдачи электронов атомом, молекулой или ионом. Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Окислительно-восстановительные реакции можно разделить на три типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования (самоокисления - самовосстановления).
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
Cu+2O + C+2O = Cu0 + C+4O2
CO - восстановитель; CuO - окислитель
Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 = 3S0 + 3H2O
Внутримолекулярные окислительно- восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
N-3H4N+5O3 -t°=N2+1O + 2H2O
N+5 - окислитель; N-3 - восстановитель
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
3K2Mn+6O4 + 2H2O = 2KMn+7O4 + Mn+4O2 + 4KOH
3HN+3O2 = HN+5O3 + 2N+2O + H2O
2N+4O2 + 2KOH = KN+5O3 + KN+3O2 + H2O
Составление уравнений окислительно-восстановительных реакций:
A Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl = KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 =KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем. Mn+7 + 5e = Mn+2 и 2Cl-1 - 2e = Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
| Mn+7 + 5e= Mn+2 | |
| 2Cl-1 - 2e = Cl20 |
------------------------
2Mn+7 + 10Cl-1 = 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции.
2KMn+7O4 + 16HCl-1 ® 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
B Электронно-ионный баланс (метод полуреакций) метод нахождения коэффициентов, в которомрассматривается обмен электронами между ионами в растворе с учетом характера среды:
| 2Cl1- - 2e = | Cl20 | ||
| MnO41- + 8H+ | + 5e = | Mn2+ + 4H2O | |
| 7+ | 2+ |
--------------------------------------
10Cl- + 2MnO41- + 16H+ ® 5Cl20 + 2Mn2+ + 8H2O
(для уравнивания ионной полуреакции используют H+, OH- или воду)
24. Гальванический элемент. Электродные процессы. Уравнение Нернста. Стандартный электродный потенциал. Ряд напряжения металлов.
Гальванический элемент – это устройство, в котором на основе окислительно-восстановительных реакций получают электрический ток, т.е. химическая энергия реакции превращается в энергию электрического тока.
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции называется электродвижущей силой данного элемента.
Электрод, на котором протекает процесс восстановления, называется катодом.
Причиной возникновения электрического тока в гальваническом элементе является разность потенциалов, возникающих на металлических электродах, которую называют разностью электродных потенциалов.
В случае электрохимических процессов полу-реакции окисления и восстановления, протекающие на соответствующих электродах называют электродными процессами.
Электродвижущие силы в случае гальванического элемента представляют в виде разности 2х величин, каждой их которых отвечают данные полу-реакции. Эти величины называются электродными потенциалами.
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов:
А) от природы реагирующих веществ участников электродного процесса;
Б) от соотношения между концентрациями (активностями) веществ;
В) от температуры.
Величина электродного потенциала зависит от концентрации ионов металла в растворе его соли [Me n +], их заряда (n) и температуры (Т), что выражается уравнением Нернста: 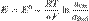
При Т =298 К можно применять упрощенную форму уравнения Нернста: 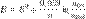
Значения стандартных электродных потенциалов можно найти в справочнике *.
, где E0 – стандартный электродный потенциал процесса. R – универсальная газовая постоянная. T – постоянная температура. Z – число электронов, участвующих в процессе.
F – число Фарадея. F=96500 Кл\моль.n - число моль электронов, участвующих в процессе, а(ох), а(red)-активности соответ оксил и восстан форм.
Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нём веществ = 1.
Электродные потенциалы металлов, измеренные по отношению к водородному электроду при стандартных условиях, т.е. активной концентрации ионов металла в растворе, равной 1 моль/л, и температуре 25°С (298 К), называют стандартными и обозначают Е °. Так, Е °(Cu2+/Cu)=0,34В, Е °(Zn2+/Zn)= –0,76В
Концентрации = 1, называются стандартными концентрациями.
Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять = 0.
Для определения потенциала того иди иного электродного процесса необходимо составить гальванический элемент из испытуемого и стандартного водородного электрода и измерить его ЭДС. Таким образом, потенциал окислительно-восстановительной системы измерим по отношению к обратимому водородному электроду, принятому за 0, при условии когда отношения активностей окисленной и восстановленной форм =1, называется стандартным электродным окислительно-восстановительным потенциалом.
Ряд металлов, расположенных в порядке возрастания их стандартных электродных потенциалов, называется рядом напряжений. В основных чертах он имеет следующий вид:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Ниже приведены основные следствия из ряда напряжений:
а) Каждый металл вытесняет из солей все другие, расположенные в ряду напряжений правее него.
б) Все металлы, расположенные левее водорода, вытесняют его из кислот, расположенные правее – не вытесняют.
в) Чем дальше друг от друга стоят два металла, тем большую ЭДС имеет построенный из них гальванический элемент.
25. Электролиз. Закон Фарадея.
В растворах или расплавах электролитов имеются разноимённые по знаку ионы, которые находятся в хаотическом движении.
Если в такой раствор или расплав ввести электроды и подключить их к источнику питания, то поле, создаваемое в растворе будет заставлять двигаться электроны.
Ионы натрия, достигнув катода, принимают электроны и становятся металлическим натрием.
Электролиз – физ-хим.процесс, состоящий в выделении на электородах составных частей растворённых веществ или др вещ-в, являющихся результом вторичных реакций на электродах, который возникает при прохождении Эл.тока через раствор либо расплав электролита.
Электрод – проводник, имеющий электронную проводимость и находящийся в контакте с ионным проводником.
Если постоянный электрический ток пропускать через систему, состоящую из двух проводников первого рода (металлы) и проводника второго рода (раствор или расплав электролита *, в который они опущены), то на границе их раздела возникают электрохимические процессы, составляющие сущность электролиза.
Сущность электролиза состоит в осуществлении за счёт электрической энергии химических реакций – восстановления на катоде и окисления на аноде.
Необходимо различать электролиз расплава электролитов и электролиз водных растворов электролитов.
При электролизе щелочей и солей оксокислот на аноде выделяется кислород: 4 OH– – 4e → 2 H2O + O2 2 SO42– – 4e → 2 SO3 + O2 При электролизе водного раствора на катоде могут восстанавливаться: 1) Ионы металлов, например Cu2+; 2) ионы водорода вкислой среде: 2H+ + 2e → H2 (E °=0 при pH=0 и E °= –0,41В при pH=7); 3) молекулы воды в нейтральной и щелочной среде: 2H2O + 2e → H2+ 2OH– (E °= –0,41В при pH=0 и E °= –0,83В при pH=14);. При электролизе водного раствора на аноде могут окисляться: 1) Анионы электролита; 2) молекулы воды в нейтральной и кислой среде: 2H2O – 4e → 4H+ + O2 (E °=1,23В); 3) ионы OH– в щелочной среде: 4OH– – 4e → 2H2O + O2 (E °=0,40В); 4) материал анода (например, медь).
Если водный раствор содержит катионы различных металлов, то при электролизе выделение их на катоде происходит в порядке уменьшения алгебраической величины стандартного электродного потенциала соответствующего металла.
Характер реакций, протекающих на аноде зависит от вещества, из которого сделан анод. Аноды подразделяют на нерастворимые и растворимые.
На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды.
Закон Фарадея: для любого замкнутого контура индуцированная ЭДС = скорости изм-я магнитного потока, проходящего через этот контур.
Количественные характеристики электролиза * выражаются двумя законами Фарадея:
А) количество вещества, окисленное на аноде, пропорционально прошедшему через раствор или расплав количеству электричества.
Б) Количество окисляющихся и восстанавливающихся на электродах веществ при протекании одного и того же количества электричества пропорциональна их химических эквивалентам.
Эти два закона можно объединить в одном уравнении: m=(M/nF)*It, где m – масса выделяющегося вещества, г, n – количество электронов, переносимых в электродном процессе; F – число Фарадея (F =96485 Кл/моль) I – сила тока, А; t – время, с; M – молярная масса выделяющегося вещества, г/моль. Согласно законам Фарадея при электролизе количество веществ, выделяющихся на электродах не зависит от температуры и концентрации раствора.
26. Комплексные соединения. Состав комплексных соединений. Номенклатура комплексных соединений. Пространственное строение комплексных соединений.
К.с.представляют собой наиболее разнообразный и обширный класс соединений, включающий органические и неорганические части. К.с.- это хим.соед-я, образованные сочетанием усложн.группировок атомов, и представл-е собой сложные ионы или молекулы, способные к существованию как в кристалл виде, так и в растворенном состоянии. При образ-и к.с., наблюдается взаимная координация взаимод-х частиц, так называемое комплексообразование. Образование сложных по составу частиц – комплексное. Причиной образования к.с.может быть как электростатич-я, так и донорно-акцепторная связь.
Вернер в 1893 составил представление о том, что к.с.состоит из внут и внеш сферы [Cu(NH3)4]SO4. Во внут сфере “r” катион называется комплексообразователем или центральным атомом. Вокруг него, в непосредственной близости, расположены отриц ионы или нейтральные молекулы, называемые лигандами. Число лигандов, окружающих центральный ион, называется координационным числом. Это число показывает кол-во сигма связей, к-е обр-ся меджду центрыльным атомом и легандами. По числу связей лиганды делятся на 1) моно, 2)ди-, 3) три-, 4) и более дентатных молекул. Внешняя сфера может содержать + и – ионы или внеш сфера может отсутствовать(если степ окисл-я внутри сферы=0). внутреннюю сферу комплекса в формуле отделяют от внешней сферы, тк внут сфера, в значении степени, сохраняет стабильность при растворении. Лиганды связаны с центр атомом ковалентными связями. Ионы, наход-я во внеш сфере связаны с комплексным ионом силами электростатич-го взаимод-я и поэтому в р-рах легко отщепляются.
В химии под номенклатурой понимают систему правил составления названий соединений. Названия к.с.строятся так же как солей и др.сложных соед-й: сначала называем анион, затое катион. название комплексного аниона начинают с указания состава внутренней сферы *. Во внутренней сфере прежде всего называют анионы, прибавляя к их названию окончание -о. Например: Cl– (хлоро-), CN–(циано-), OH– (гидроксо-) и т.д. Далее называют нейтральные лиганды *. При этом для аммиака используют название “аммин”, для воды – “аква”. Количество лигандов указывают греческими числительными: 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем называюткомплексообразователь *, используя для него латинское название и окончание -ат, после чего римскими цифрами в скобках указываютстепень окисления * комплексообразователя. После обозначения состава внутренней сферы называют внешнесферные катионы.
Если комплексообразователь входит в состав катиона, то название внутренней сферы составляют так же, как в случае комплексного аниона, но используют русское название комплексообразователя и в скобках указывают степень его окисления. Примеры: K[Fe(NH3)2(CN)4] – тетрацианодиамминферрат (III) калия K4[Fe(CN)6] – гексацианоферрат (II) калия Na2[PtCl6] – гексахлороплатинат (IV) калия.
К основным типам комплексных соединений относят следующие:
Аммиакаты – комплексы, в которых лигандами * служат молекулы аммиака, например [Cu(NH3)4]SO4, [Co(NH3)6]Cl3.
Аквакомплексы – лигандами являются молекулы воды: [Co(H2O)6]Cl2, [Al(H2O)6]Cl3.
Ацидокомплексы – лигандами являются анионы. Ацидокомплексы можно представить как продукты сочетания двух солей. Например: PtCl4·2KCl или K2[PtCl6], Fe(CN)2·4KCN или K4[Fe(CN)6] (желтая кровяная соль), Fe(CN)3·3KCN или K3[Fe(CN)6] (красная кровяная соль).
- Элементы главной подгруппы первой, второй группы периодической системы.
Элементы первой и второй главных подгрупп – S-элементами, у которых электронами заполняется s-подуровень внешнего слоя. При это на s один или 2 электрона. Всего их 14.
IА (литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr,) - щелочные металлы, IIА (бериллий, магний, кальций, стронций, барий и радий) - щелочноземельные металлы. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами. В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns1. Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Они выражены особенно ярко и усиливаются с номером элемента. Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калийлегче воды и плавают на её поверхности, реагируя с ней. Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий: 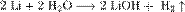 у остальных происходят взрывы.
у остальных происходят взрывы.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла. Только литий сгорает на воздухе с образованием оксида стехиометрического состава:  При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2: 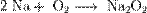 В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды: 
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода: 
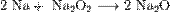
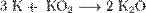
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами: 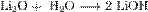
Пероксиды и надпероксиды проявляют свойства сильных окислителей: 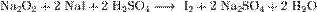
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды: 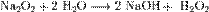
3.Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованиемгидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов исилицидов: 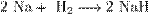 Соли гидролизуются. Ph > 7
Соли гидролизуются. Ph > 7
Элементы главной подгруппы второй группы периодической системы.
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы главной подгруппы: бериллий, магний, кальций, стронций, барий ирадий[1][2]. Относятся ко 2-й группе элементов. Соли щёлочноземельных металлов, кроме радия, широко распространены в природе в виде минералов. Все щёлочноземельные металлы — серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и во всех соединениях имеют степень окисления +2 (очень редко +1). Образующие молекулы имеют линейное строение. Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера. Щелочноземельные металлы энергично реагируют с водой, вытесняя водород и образуя гидроксиды, как и щелочные металлы. Магний взаимодействует только с кипящей водой, а бериллий не реагирует даже с парами при высокой температуре. Восстан активность увеличиватся от бериллия к радию. 2Ca + O2= 2CaO +Q Все эти элементы реагируют с разбавленными растворами минеральных кислот (типа HCl), а бериллий растворяется менее энергично. При взаимодействии с кислородом Be и Mg образуют оксиды МО, а другие, более активные металлы, могут образовывать и пероксиды, например BaO2. Пероксиды могут образовываться и по реакции гидроксидов Ca, Sr и Ba с H2O2. Растворимость гидроксидов возрастает по мере увеличения радиуса иона и ослабления притяжения между ионом металла и гидроксид-ионом. Соли получают взаимодействием оксидов или гидрооксидов.
- Элементы главной подгруппы третьей группы периодической системы- подгру́ппа бо́ра
( бор, алюминий, галлий, индий, таллий) Все элементы данной подгруппы, за исключением бора, металлы.
Алюминий — основной представитель металлов главной подгруппы III группы Периодической системы. Свойства его аналогов — галлия, индия и таллия — напоминают свойства алюминия, поскольку все эти элементы имеют одинаковую электронную конфигурацию внешнего уровня ns2nр1 и могут проявлять степень окисления +3. С увеличением атомной массы усиливается металлический характер элементов. Бор — неметалл, остальные элементы (подгруппа алюминия) — металлы. Бор значительно отличается по свойствам от остальных элементов и больше похож на углерод и кремний. Остальные элементы — легкоплавкие металлы, In и Тl — чрезвычайно мягкие. Все элементы группы трехвалентны, но с увеличением атомного номера более характерной становится валентность 1 (Тl преимущественно одновалентен). В ряду В—Аl—Gа—In—Тl уменьшается кислотность и увеличивается основность гидроксидов R(ОН)3. Н3ВО3 — кислота, Аl(ОН)3 и Gа(ОН)3 — амфотерные основания,In(ОН)3 и Тl(ОН)3 — типичные основания. ТlOН — сильное основание.
Бор — бесцветный, серое или красное кристаллическое либо тёмное аморфное вещество. Неметалл. Занимает по твердости второе место, после алмаза. Алюминий — легкий металл серебристо-белого цвета. Отличается высокой тепло- и электропроводностью. Галлий — легкий металл серебристо-белого цвета. Индий — легкий металл серебристо-белого цвета. Очень пластичный. Один из самых мягких элементов таблицы Менделеева. Таллий — тяжелый металл бело-голубого цвета. Очень мягок и затвердевает только при температуре от —59 С°
Поверхность алюминия обычно покрыта прочной пленкой оксида Аl2О3, которая предохраняет его от взаимодействия с окружающей средой. Если эту пленку удаляют, то металл может энергично реагировать с водой: 2Аl + 6Н2О = 2Аl(ОН)3 + ЗН2↑. Бор, в отличие от алюминия, химически инертен (особенно кристаллический). Так, с кислородом он реагирует только при очень высоких температурах (> 700°С) с образованием борного ангидрида В2О3: 2В + ЗО2 = 2В2О3, с водой бор не реагирует ни при каких обстоятельствах. При еще более высокой температуре (> 1200°С) он взаимодействует с азотом, давая нитрид бора (служит для изготовления огнеупорных материалов): 2B + N2 = 2BN. В результате гидролиза образуется ортоборная (борная) кислота H3BO3: ВНаl3 + 3Н2О = Н3ВО3 + ЗННаl. В отличие от бора, алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С). Алюминий легко растворяется
 2018-01-21
2018-01-21 2065
2065







