Белков, углеводов и жиров в организме.
I:
S:Совокупность реакций окисления, протекающих в клетке и обеспечивающих организм энергией в доступной для использования форме, это……….
+: биологическое окисление
-: метаболизм
-: амфиболизм
-: среди ответов нет верного
I:
S:Общая стадия для аэробного и анаэробного дыхания — это………
+: путь Эмбдена — Мейергофа
-: цикл Кребса
-: дыхательная цепь
-: среди ответов нет верного
I:
S:Гликолиз — это……..
+: путь Эмбдена — Мейергофа
-: цикл Кребса
-: дыхательная цепь
-: среди ответов нет верного
I:
S:Выбирите синонимы названий метаболических процессов……….
-: путь Эмбдена — Мейергофа
+: цикл Кребса
-: дыхательная цепь
-: среди ответов нет верного
I:
S:Выбирите синонимы названий метаболических процессов………
+: цикл лимонной кислоты
-: путь Эмбдена — Мейергофа
-: дыхательная цепь
-: среди ответов нет верного
I:
S:Выбирите синонимы названий метаболических процессов………
-: путь Эмбдена — Мейергофа
-: дыхательная цепь
-: среди ответов нет верного
+: цикл трикарбоновых кислот
I:
S:Окислительное декарбоксилирование —это……..
-: путь Эмбдена — Мейергофа
+: цикл Кребса
-: дыхательная цепь
-: среди ответов нет верного
I:
S:Окислительное фосфорилирование — это………
-: путь Эмбдена — Мейергофа
-: цикл Кребса
+: дыхательная цепь
г. среди ответов нет верного
I:
S:Характерно для аэробного дыхания……….
-: путь Эмбдена -— Мейергофа
+: цикл Кребса
-: среди ответов нет верного
-: путь Дрофа
I:
S:Характерно для аэробного дыхания……..
+: дыхательная цепь
-: путь Эмбдена -— Мейергофа
-: среди ответов нет верного
-: путь Дроффа
I:
S:Органеллы животной клетки, которые выполняют функцию окислительного фосфорилирования при дыхательном обмене, — это…….
+: митохондрии
-: лейкопласты
-: лизосомы
-: среди ответов нет верного
I:
S:В животной клетке процесс бескислородного расщепления глюкозы — анаэробный гликолиз — протекает в…….
-: митохондриях
-: лейкопластах
-: лизосомах
+: матриксе цитоплазмы
I:
S:Совокупность реакций, сопровождающихся освобождением энергии, используемой клеткой для своего энергообеспечения, — это………
-: пластический обмен
+: энергетический обмен
-: обмен веществ и энергии
-: среди ответов нет верного
I:
S:Расщепление крупных биомолекул на более простые с незначительным освобождением энергии происходит на этапе энергетического обмена…….
+: подготовительном
-: бескислородном
-: кислородном
-: среди ответов нет верного
I:
S:Многоступенчатый ферментативный распад на внутриклеточных мембранах происходит на этапе энергетического обмена………
-: подготовительном
+: бескислородном
-: кислородном
-: среди ответов нет верного
I:
S:Ряд ферментативных реакций с участием Н3Р04 происходит на этапе энергетического обмена……..
-: подготовительном
-: бескислородном
+: кислородном
-: среди ответов нет верного
I:
S:Гликолиз, брожение — примеры процессов, происходящих на этапе энергетического обмена………
-: подготовительном
+: бескислородном
-: кислородном
-: среди ответов нет верного
I:
S:АТФ, СО2, Н20—продукты этапа энергетического обмена…….
-: подготовительного
-: бескислородного
+: кислородного
-: среди ответов нет верного
V18. Регуляция обмена веществ на различных
Уровнях организма.
I:
S:Взаимопревращения биомолекул происходят в процессе……..
-: катаболизма
-: анаболизма
-: амфиболизма
+: метаболизма
I:
S:На использование химических веществ, поступающих в организм, в процессах роста, развития, обновления структур организма, накопления запасов, которые в дальнейшем могут послужить источником энергии, направлены процессы……..
+: ассимиляции
-: диссимиляции
-: амфиболизма
-: метаболизма
I:
S:Разрушение молекул до их структурных составляющих – это……..
-: ассимиляция
+: диссимиляция
-: амфиболизм
-: метаболизм
I:
S:Превращения веществ в организме, происходящие от момента их поступления в клетки до образования конечных продуктов обмена, - это……
-: ассимиляция
-: диссимиляция
-: амфиболизм
+: промежуточный обмен
I:
S:Совокупность процессов ферментативного синтеза биомолекул из их структурных составляющих – это…….
-: катаболизм
+: анаболизм
-: амфиболизм
-: метаболизм
I:
S:Совокупность процессов ферментативного распада биомолекул из их структурных составляющих – это……….
+: катаболизм
-: анаболизм
-: амфиболизм
-: метаболизм
I:
S:Метаболические пути, общие для анаболизма и катаболизма, - это……..
-: ассимиляция
-: диссимиляция
+: амфиболизм
-: среди ответов нет верного
I:
S:Регуляция обмена веществ и энергии осуществляется на………..
+: различных уровнях организации живых систем
-: только на молекулярном уровне
-: только на клеточном уровне
-: только на макроорганизменном уровне
I:
S:На молекулярном уровне осуществляется регуляция……….
-: распределения субстратов, метаболитов и ферментов
+: полиферментных систем
-: действием гормонов
-: среди ответов нет верного
I:
S:На клеточном уровне осуществляется регуляция……….
+: распределения субстратов, метаболитов и ферментов
-: полиферментных систем
-: действием гормонов
-: среди ответов нет верного
I:
S:На макроорганизменном уровне осуществляется регуляция……….
+: распределения субстратов, метаболитов и ферментов
-: полиферментных систем
-: действием гормонов
-: среди ответов нет верного
I:
S:Регуляторные ферменты называются………..
-: эффекторами
-: модуляторами
+: аллостерическими ферментами
-: среди ответов нет верного
I:
S:Структуры, на которые реагирует иммунная система, называются……..
+: антигенами
-: антителами
-: комплексами тканевой совместимости
-: среди ответов нет верного
V19. Основные теоретические положения аналитической химии.
Введение в предмет аналитической химии.
I:
S: Наука об определении химического состава веществ и
отчасти их химического строения — это химия……….
-: общая
-: неорганическая
+: аналитическая
-: среди ответов нет верного
I:
S: Основными составляющими аналитической химии являются……….
+: качественный и количественный анализ, физико-химические методы анализа
-: качественный и количественный анализ
-: количественный анализ и физико-химические методы анализа
-: среди ответов нет верного
I:
S: Совокупность действий, которые имеют своей целью получение информации о химическом составе объекта — это………..
-: метод анализа
+: химический анализ
-: методика анализа
-: среди ответов нет верного
I:
S: Достаточно универсальный и теоретически обоснованный
способ определения состава безотносительно к определяемому
компоненту и (обычно) к анализируемому объекту — это………..
+: метод анализа
-: химический анализ
-: методика анализа
-: среди ответов нет верного
I:
S: Подробное описание анализа данного объекта с использованием выбранного метода — это…………
-: метод анализа
-: химический анализ
+: методика анализа
-: среди ответов нет верного
I:
S: Раздел химии, изучающий механизмы химических реакций и скорости их протекания, — это…………..
+: химическая кинетика
-: химический анализ
-: химическая термодинамика
-: среди ответов нет верного
I:
S: Характеризуются отсутствием поверхности раздела между реагентами реакции….
-: гетерогенные
+: гомогенные
-: обратимые
-: необратимые
I:
S: Реакции между газообразными веществами — это реакции………….
-: гетерогенные
+: гомогенные
-: гетерогенные или гомогенные
-: среди ответов нет верного
I:
S: Характеризуются наличием поверхности раздела между
реагентами, где и протекает их взаимодействие, реакции…………..
+: гетерогенные
-: гомогенные
-: гетерогенные или гомогенные
-: среди ответов нет верного
I:
S: Последовательность элементарных актов взаимодействия
реагентов — это………………
-: скорость реакции
-: кинетика реакции
+: механизм реакции
-: среди ответов нет верного
I:
S: Определяется изменением концентрации реагирующих веществ в единицу времени………..
+: скорость реакции
-: кинетика реакции
-: механизм реакции
-: среди ответов нет верного
I:
S: Реакции, которые протекают только в одном направлении до полного израсходования одного из реагирующих веществ — это………….
-: гетерогенные
-: гомогенные
+: необратимые
-: обратимые
I:
S: Реакции, в которых одновременно протекают две взаимно противоположные реакции (прямая и обратная)— это…………
-: гетерогенные
-: гомогенные
-: необратимые
+: обратимые
I:
S: При химическом равновесии………….
+: скорости прямой и обратной реакции равны
-: скорость прямой реакции больше скорости обратной реакции
-: скорость обратной реакции больше скорости прямой
реакции
-: среди ответов нет верного
I:
S: Критерием смещения химического равновесия вправо
является условие…………..
+: Кравн > 1
-: Кравн <1
-: Кравн =1
-: среди ответов нет верного
I:
S: Критерием смещения химического равновесия влево
является условие…………..
-: Kравн > 1
+: Кравн <1
-: Кравн =1
-: среди ответов нет верного
I:
S: Постулат «если на систему, находящуюся в состоянии
химического равновесия, оказывать воздействие путем изменения концентрации реагентов, давления или температуры в системе, то равновесие всегда смещается в направлении той реакции, протекание которой ослабляет это воздействие» — это………….
-: правило Вант-Гоффа
-: закон Гесса
+: принцип Ле Шателье
-: среди ответов нет верного
I:
S: Увеличение концентрации исходных веществ……….
+: вызывает смещение равновесия в сторону образования
конечных продуктов
-: вызывает смещение равновесия в сторону образования
исходных продуктов
-: не вызывает смещения равновесия
-: среди ответов нет верного
I:
S: Давление в системе изменяет концентрацию………
-: только твердых веществ
+: только газообразных веществ
-: как твердых, так и газообразных веществ
-: среди ответов нет верного
I:
S: Повышение давления в системе………….
-: смещает химическое равновесие в направлении реакции, иду-
щей с образованием большего числа молей газообразных веществ
-: не смещает химическое равновесие
+: смещает химическое равновесие в направлении реакции, иду-
щей с образованием меньшего числа молей газообразных веществ
-: среди ответов нет верного
I:
S: Изменение давления не смещает химическое равновесие……….
+: при равном числе молей газообразных исходных и конечных веществ
-: при большем числе молей газообразных исходных веществ
-: при большем числе молей газообразных конечных веществ
-: среди ответов нет верного
I:
S: Повышение температуры…………..
+: вызывает смещение равновесия в сторону экзотермической реакции
-: вызывает смещение равновесия в сторону эндотермической реакции
-: не смещает химическое равновесие
-: среди ответов нет верного
I:
S: Гомогенная система, состоящая из двух или более независимых компонентов, соотношения между которыми могут изменяться, — это……
+: раствор
-: истинный раствор
-: коллоидный раствор
-: среди ответов нет верного
I:
S: Гомогенные системы с размером частиц на уровне 10-10-10-9 м — это………
-: растворы
+: истинные растворы
-: коллоидные растворы
-: среди ответов нет верного
I:
S: Гетерогенные системы с размером частиц на уровне 10-9-10-6 м — это….
-: растворы
-: истинные растворы
+: коллоидные растворы
-: среди ответов нет верного
I:
S: Раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянное значение рН при разбавлении или при добавлении небольших количеств кислоты или щелочи, — это……………
+: буферный раствор
-: кислотная буферная система
-: основная буферная система
-: буферная емкость
I:
S: Раствор, содержащий слабую кислоту (донор протона - и
соль этой кислоты (акцептор протон — это………..
-: буферный раствор
+: кислотная буферная система
-: основная буферная система
-: буферная емкость
I:
S: Раствор, содержащий слабое основание (акцептор про-
тон - и соль этого основания (донор протон — это………..
-: буферный раствор
-: кислотная буферная система
+: основная буферная система
-: буферная емкость
I:
S: Число моль-эквивалентов сильной кислоты или щелочи,
которые нужно добавить к 1 литру буферного раствора, чтобы
изменить величину рН на единицу, — это………..
-: буферный раствор
-: кислотная буферная система
-: основная буферная система
+: буферная емкость
I:
S: Гидролизу не подвергаются………….
+: Соли, образованные сильными основаниями и сильными кислотами
-: Соли, образованные сильной кислотой и слабым основанием
-: Соли, образованные слабой кислотой и сильным основанием
-: Нет правильного ответа
I:
S: Гидролизу по катиону подвергаются ……….
-: Соли, образованные сильными основаниями и сильными кислотам
+: Соли, образованные сильной кислотой и слабым основанием
-: Соли, образованные слабой кислотой и сильным основанием
-: Соли, образованные слабой кислотой и слабым основанием
I:
S: Гидролизу по аниону подвергаются……..
-: Соли, образованные сильными основаниями и сильными кислотам
-: Соли, образованные сильной кислотой и слабым основанием
+: Соли, образованные слабой кислотой и сильным основанием
-: Соли, образованные слабой кислотой и слабым основанием
I:
S: Гидролиз по катиону и аниону подвергаются……..
-: Соли, образованные сильными основаниями и сильными кислотам
-: Соли, образованные сильной кислотой и слабым основанием
-: Соли, образованные слабой кислотой и сильным основанием
+: Соли, образованные слабой кислотой и слабым основанием
V20. Подготовка проб к проведению химического анализа.
I:
S: Качественный анализ……….
+: Определяет, какие компоненты включает анализируемый объект
-: Анализ изотопный, элементный (атомно-ионный), структурно-групповой (функциональный), молекулярный, вещественный, фазовый
-: Дает сведения о количественном содержании всех или отдельных компонентов
-: Макро-, полумикро-, микро-, ультрамикро- и субмикроанализы
I:
S: Количественный анализ…………
-: Определяет, какие компоненты включает анализируемый объект
-: Анализ изотопный, элементный (атомно-ионный), структурно-групповой (функциональный), молекулярный, вещественный, фазовый
+: Дает сведения о количественном содержании всех или отдельных компонентов
-: Макро-, полумикро-, микро-, ультрамикро- и субмикроанализы
I:
S: Классификация по масштабу работы, объему или массе пробы……….
-: Определяет, какие компоненты включает анализируемый объект
-: Анализ изотопный, элементный (атомно-ионный), структурно-групповой (функциональный), молекулярный, вещественный, фазовый
-: Дает сведения о количественном содержании всех или отдельных компонентов
+: Макро-, полумикро-, микро-, ультрамикро- и субмикроанализы.
I:
S: Классификация, основанная на природе обнаруживаемых и определяемых частиц……….
-: Определяет, какие компоненты включает анализируемый объект
+: Анализ изотопный, элементный (атомно-ионный), структурно-групповой (функциональный), молекулярный, вещественный, фазовый
-: Дает сведения о количественном содержании всех или отдельных компонентов
-: Макро-, полумикро-, микро-, ультрамикро- и субмикроанализы
I:
Q:. Установите последовательность…………
L1: 1L2: 2L3: 3L4: 4L5: 5R1: отбор пробыR2: подготовка пробы к анализуR3: определение концентрации или количества компонентаR4: измерение аналитического сигнала
R5: фиксация полезного аналитического сигнала
I:
S: Величина полезного аналитического сигнала — это………….
+: измеренный аналитический сигнал — аналитический сигнал фона
-: измеренный аналитический сигнал + аналитический сигнал фона
-: аналитический сигнал фона — измеренный аналитический сигнал
-: аналитический сигнал фона + измеренный аналитический сигнал
I:
S: Физическая величина, функционально связанная с содержанием компонента, — это………..
+: аналитический сигнал
-: аналитический сигнал фона
-: полезный аналитический сигнал
-: среди ответов нет верного
I:
S: Аналитический сигнал, обусловленный примесями определяемого компонента и (или) компонентов, мешающих определению, — это………
-: аналитический сигнал
+: аналитический сигнал фона
-: полезный аналитический сигнал
-: среди ответов нет верного
I:
S: Через все стадии химического анализа проводится проба,
не содержащая определяемого компонента, при методе………..
+: контрольного опыта («холостого опыта»)
-: градуировочного графика
-: стандартов
-: среди ответов нет верного
I:
S: Строится график в координатах «аналитический сигнал —
содержание определяемого компонента с использованием образцов сравнения с различным и точно известным содержанием
исследуемого компонента», по которому находят искомое содержание компонента при методе…………..
-: контрольного опыта («холостого опыта»)
+: градуировочного графика
-: стандартов
-: среди ответов нет верного
I:
S: Измеряют величины аналитических сигналов в образце
сравнения с известным содержанием компонента и в анализируемой пробе при методе……….
-: контрольного опыта («холостого опыта»)
-: градуировочного графика
+: стандартов
-: среди ответов нет верного
I:
S: Операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются один от другого— это…………
+: разделение
-: концентрирование
-: абсолютное концентрирование
-: относительное концентрирование
I:
S: Операция (процесс), в результате которой повышается
отношение концентрации или количества микрокомпонентов к
концентрации или количеству макрокомпонента, — это…………
-: разделение
+: концентрирование
-: абсолютное концентрирование
-: относительное концентрирование
I:
S: Операция (процесс), в результате которой вещества,
присутствующие в малом количестве, собираются в меньшем
объеме или массе, — это…………
-: разделение
-: концентрирование
+: абсолютное концентрирование
-: относительное концентрирование
I:
S: Операция (процесс), в результате которой вещества, присутствующие в малом количестве, отделяются от макрокомпонента таким образом, что отношение концентрации микрокомпонента к концентрации макрокомпонента повышается— это…………
-: разделение
-: концентрирование
-: абсолютное концентрирование
+: относительное концентрирование
V21. Качественный химический анализ. Составляющие качественного химического анализа.
I:
S: Вид анализа, который ориентирован на выявление химического состава анализируемого образца (определение наличия тех или иных катионов и анионов — это анализ………….
+: качественный
-: количественный
-: вещественный
-: среди ответов нет верного
I:
S: Позволяют выделить осадок смеси веществ, который подвергают дальнейшему разделению и анализу, используя различия в химических свойствах…………
-: групповые реактивы
+: общие реактивы
-: частные реакции
-: среди ответов нет верного
I:
S: Способность осадков осаждаться или растворяться в присутствии кислот, оснований, раствора аммиака послужила основанием для выделения…………..
+: групповых реактивов
-: общих реактивов
-: частных реакций
-: среди ответов нет верного
I:
S: Вид анализа, показывающий, из каких элементов состоит
данный объект, какова их концентрация или количество— это
анализ……….
-: изотопный
-: вещественный
-: молекулярный
+: элементный
I:
S: Вид анализа, показывающий, в какой форме присутствует
интересующий нас компонент в анализируемом объекте и каково содержание этих форм— это анализ………….
-: изотопный
+: вещественный
-: молекулярный
-: элементный
I:
S: Вид анализа, имеющий много общего с молекулярным и фазовым, — это анализ….
-: изотопный
+: вещественный
-: элементный
-: среди ответов нет верного
I:
S: Обнаружение и определение химических соединений —это анализ………
-: изотопный
-: вещественный
+: молекулярный
-: элементный
I:
S: Определение функциональных групп органических соединений — это анализ………….
-: фазовый
+: структурно-групповой
-: молекулярный
-: элементный
I:
S: Анализ включений в неоднородном объекте — это анализ……….
+: фазовый
-: структурно-групповой
-: молекулярный
-: элементный
I:
S: Требования к аналитическим реакциям следующие………..
+: реакции должны протекать быстро, практически мгновенно
-: реакции должны протекать медленно
-: реакции должны быть обратимыми
-: отсутствие внешних эффектов
I:
S: Требования к аналитическим реакциям следующие…………..
+: реакции должны быть необратимыми
-: реакции должны протекать медленно
-: реакции должны быть обратимыми
-: отсутствие внешних эффектов
I:
S: Требования к аналитическим реакциям следующие……
-: реакции должны протекать медленно
-: реакции должны быть обратимыми
+: наличие внешних эффектов
-: отсутствие внешних эффектов
I:
S: Требования к аналитическим реакциям следующие……..
-: реакции должны протекать медленно
-: реакции должны быть обратимыми
+: высокая чувствительность и специфичность
-: отсутствие внешних эффектов
I:
S: Условия проведения аналитических реакций следующие……
+: соблюдение рН среды
-: реакции должны быть необратимыми
-: реакции должны протекать медленно
-: наличие внешних эффектов
I:
S: Условия проведения аналитических реакций следующие……
-: реакции должны быть необратимыми
-: реакции должны протекать медленно
+: наличие достаточной для обнаружения концентрации иона
-: наличие внешних эффектов
V22. Основы химической термодинамики. Основные понятия.
I:
S: Химическая термодинамика изучает…..
-: количественный состав химических смесей
-: качественный состав химических смесей
+: переходы энергии из одной формы в другую, от одной части системы к другой
-: внутреннее строение тел и механизм протекающих в них процессов
I:
S: Химическая термодинамика изучает…..
-: количественный состав химических смесей
-: качественный состав химических смесей
+: энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов
-: внутреннее строение тел и механизм протекающих в них процессов
I:
S: Химическая термодинамика изучает…..
-: количественный состав химических смесей
-: качественный состав химических смесей
+: Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях
-: внутреннее строение тел и механизм протекающих в них процессов
I:
S: Термодинамика не рассматривает…..
-: термохимические процессы
-: качественный состав химических смесей
+: внутреннее строение тел и механизм протекающих в них процессов
-: возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях
I:
S: Классическая термодинамика изучает только ……..
-: микроскопические системы
-: процессы, для которых присутствует понятие «время»
+: макроскопические системы
-: структурный состав молекул
I:
S: В термодинамике отсутствует понятие. ……..
-: термодинамическая система
-: термодинамическая функция
+: время
-: энтропия
I:
S: Термодинамическая система это……
-: группа атомов, находящихся во взаимодействии между собой
-: группа молекул, находящихся во взаимодействии между собой
+: тело или группа тел, находящихся во взаимодействии, мысленно или реально обособленные от окружающей среды
-: группа молекул, которые не находятся во взаимодействии между собой
I:
S: Гомогенная система - это система……..
-: внутри которой имеется поверхность, разделяющая отличающиеся по свойствам части системы (фазы)
-: представляющая собой группу молекул, которые находятся во взаимодействии между собой
+: внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы)
-: представляющая собой группу молекул, которые не находятся во взаимодействии между собой
I:
S: Гетерогенная система - это система……..
-: внутри которой нет поверхностей, разделяющих отличающиеся по свойствам части системы (фазы)
-: представляющая собой группу молекул, которые находятся во взаимодействии между собой
+: внутри которой имеется поверхность, разделяющая отличающиеся по свойствам части системы (фазы)
-: представляющая собой группу молекул, которые не находятся во взаимодействии между собой
I:
S: Фаза это……
-: группа атомов, которые находятся во взаимодействии между собой
-: группа молекул, которые находятся во взаимодействии между собой
+: совокупность гомогенных частей гетерогенной системы, одинаковых по физическим и химическим свойствам, отделённая от других частей системы видимыми поверхностями раздела
-: группа молекул, которые не находятся во взаимодействии между собой
I:
S: Изолированная система это…….
-: система, которая обменивается с окружающей средой энергией, но не обменивается веществом
-: система, которая обменивается с окружающей средой и веществом, и энергией
+: система, которая не обменивается с окружающей средой ни веществом, ни энергией
-: группа молекул, которые не находятся во взаимодействии между собой
I:
S: Открытая система это………..
-: система, которая не обменивается с окружающей средой ни веществом, ни энергией
-: группа молекул, которые находятся во взаимодействии между собой
+: система, которая обменивается с окружающей средой и веществом, и энергией
-: система, которая обменивается с окружающей средой энергией, но не обменивается веществом
I:
S: Закрытая система это………
-: система, которая обменивается с окружающей средой и веществом, и энергией
-: группа молекул, которые находятся во взаимодействии между собой
+: система, которая обменивается с окружающей средой энергией, но не обменивается веществом
-: система, которая не обменивается с окружающей средой ни веществом, ни энергией
I:
S: Параметры состояния системы это ………
-: все величины, характеризующие какое-либо микроскопическое свойство рассматриваемой системы
-: все величины, имеющие положительные значения
+: все величины, характеризующие какое-либо макроскопическое свойство рассматриваемой системы
-: все величины, имеющие отрицательные значения
I:
S: Для механической работы факторами интенсивности и экстенсивности соответственно являются…………….
-: изменение объема (м3) и давление (Па)
-: путь (м) и сила (Н)
+: сила (Н) и путь (м)
-: давление (Па) и изменение объема (м3)
I:
S: Для работы расширения факторами интенсивности и экстенсивности соответственно являются…………….
-: изменение объема (м3) и давление (Па)
-: 
+: давление (Па) и изменение объема (м3)
-: сила (Н) и путь (м)
I:
S: Для электрической работы факторами интенсивности и экстенсивности соответственно являются…………….
-: количество электричества (Кл) и разность потенциалов (В)
-: 
+: разность потенциалов (В) и количество электричества (Кл)
-: сила (Н) и путь (м)
I:
S: Для гравитационной работы факторами интенсивности и экстенсивности соответственно являются…………….
-: количество электричества (Кл) и разность потенциалов (В)
-: 
+: 
-: разность потенциалов (В) и количество электричества (Кл)
I:
S: Для работы по изменению поверхности (Дж)факторами интенсивности и экстенсивности соответственно являются…………….
-: 
-: 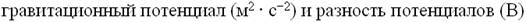
+: 
-: 
I:
S: Интенсивными называют такие величины (параметры и определяемые ими свойства), величина которых……
-: зависит от массы и не имеют тенденцию к выравниванию по всему объему системы (напр.температура, концентрация, потенциалы, давление и т.д
-: имеет целые положительные значения
+: не зависит от массы и имеют тенденцию к выравниванию по всему объему системы (напр.температура, концентрация, потенциалы, давление и т.д
-: имеет целые положительные и отрицательные значения
I:
S: Экстенсивныминазывают такие свойства, величина которых……
-: не пропорциональна массе и не обладает свойствами аддитивности
-: имеет целые положительные значения
+: пропорциональна массе и обладает свойствами аддитивности
-: имеет целые отрицательные значения
I:
S: Система находится в состоянии термодинамического равновесия, если……
-: ее состояние не зависит от температуры
-: ее состояние не зависит от давления
+: значения параметров одинаковы в любой точке системы и остаются одинаковыми во времени
-: ее состояние не зависит от концентрации компонентов
I:
S: Процесс называется обратимым, когда ……
-: система быстро переходит из одного состояния равновесия в другое
-: его возможно реализовать в обратном направлении только с применением внешних воздействий
+: система бесконечно медленно переходит из одного состояния равновесия в другое через непрерывный ряд промежуточных равновесных состояний
-: его протекание не зависит от температуры
I:
S: Процесс называется необратимым, когда…
-: система быстро переходит из одного состояния равновесия в другое
-: его протекание не зависит от давления
+: в результате протекания процессов в прямом и обратном направлениях в системе или в окружающей среде останутся неисчезающие изменения
-: система бесконечно медленно переходит из одного состояния равновесия в другое через непрерывный ряд промежуточных равновесных состояний
I:
S: Внутренняя энергия системы это…. …
-: сумма кинетической и потенциальной энергии молекул одного вида
-: потенциальная энергия, обусловленная положением системы в пространстве
+: сумма кинетической и потенциальной энергии всех частиц, составляющих систему
-: кинетическая энергия движения системы как целого
I:
S: Внутренняя энергия вещества зависит только от......
-: пути которым данное вещество приведено в данное состояние
-: потенциальной энергии, обусловленной положением системы в пространстве
+: его физического состояния
-: способа которым данное вещество приведено в данное состояние
I:
S: Внутренняя энергия вещества……
-: не является функцией состояния
-: зависит от способа или пути, которыми данное вещество приведено в данное состояние
+: не зависит от способа или пути, которыми данное вещество приведено в данное состояние
-: не зависит от его физического состояния
I:
S: Теплота Q ……
-: является функцией состояния
-: не является формой передачи энергии путём неупорядоченного движения молекул
+: зависит от способа или пути, которыми данное вещество приведено в данное состояние
-: не является функцией пути процесса
I:
S: Работа (А) …..
-: является функцией состояния
-: не является формой передачи энергии путём неупорядоченного движения молекул
+: является количественной мерой направленного движения частиц
-: не является функцией пути процесса
V22. Начала термодинамики
I:
S: Формулировки 1-ого начала термодинамики: …..
-:: в замкнутой системе сумма всех видов энергии не постоянна
-: полная энергия изолированной системы не постоянна
+: энергия неуничтожаема и несотворяема; она может только переходить из одной формы в другую в эквивалентных соотношениях
-: энергия не может только переходить из одной формы в другую в эквивалентных соотношениях
I:
S: 
-: теплота, подведенная к системе, расходуется только на приращение внутренней энергии системы
-: теплота, подведенная к системе, расходуется только на совершение работы системой над внешней средой
+: теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над внешней средой.
-: теплота, подведенная к системе, расходуется только на работу внешней среды над системой
I:
S: 
-: dU – не является полным дифференциалом внутренней энергии
-: Символ (d) – обозначает бесконечно малое изменение функции процесса
+: dU – полный дифференциал внутренней энергии
-: Символ (δ) – обозначает бесконечно малое изменение функции состояния
I:
S: Уравнение, которое является математической записью 1-го начала термодинамики для конечного состояния системы………
-: 
-: 
+: 
-: 
I:
S: Уравнение для бесконечно малого изменения состояния системы…
-: 
-: 
+: 
-: 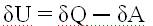
I:
S: Уравнение Клапейрона - Менделеева …
-: p•V = nR / T
-: p / V = nRT
+: p•V = nRT
-: p•V = n / RT
I:
S: Работа расширения для изолированной системы при
изотермическом процессе (Т = const и U = const, dU = 0) равна……
-: А = n/R•T•1n (Р1/Р2)
-: А = n•R/T•1n (Р1/Р2)
+: А = n•R•T•1n (Р1/Р2)
-: А = n•R•T/1n (Р1/Р2)
I:
S: Работа расширения для изолированной системы при изохорном процессе (V = const; dV = 0) равна……
-: А = n/R•T•1n (Р1/Р2)
-: А = n•R/T•1n (Р1/Р2)
+: А = Р•ΔV = 0
-: А = n•R•T / 1n (Р1/Р2)
I:
S: QV – тепловая энергия в изолированной системе для изохорного процесса (V = const; dV = 0) равна……
-: QV = n/R•1n (Р1/Р2)
-: QV = n•R/1n (Р1/Р2)
+: 
-: QV = T/1n (Р1/Р2)
I:
S: QР -тепловая энергия в изолированной системе для изобарного процесса
(р = const, dр = 0) равна……
-: QР =  U
U
-: QР =  Т
Т
+: QР =  Н
Н
-: QР =  Р
Р
I:
S: Соотношение между Qp и QV для реакции междуидеальными газами в изолированной системе ……..
-: QР = QV
-: QР = QV +  n / R•Т
n / R•Т
+: Qp = QV +  n•R•Т
n•R•Т
-: QР = QV +  n•R / Т
n•R / Т
I:
S: Соотношение между Qp и QV для реакции междуидеальными газами в изолированной системе ……..
-: QР = QV
-: QР = QV +  n / R•Т
n / R•Т
+: Qp = QV +  n•R•Т
n•R•Т
-: QР = QV +  n•R / Т
n•R / Т
I:
S: При адиабатическом процессе работа расширения в изолированной системе равна…..
-: A = -  Р
Р
-: A = -  Т
Т
+: A = -  U
U
-: A = -  С
С
I:
S: Работа, произведённая газом при его адиабатическом расширении в изолированной системе, равна…….
-: A = - СV•  Н
Н
-: A = - СV•  Р
Р
+: A = - СV•  Т
Т
-: A = - СV•  Q
Q
I:
S: Теплоемкостью называют…….
-: количество теплоты, соответствующее изменению температуры единицы количества вещества на 1 ОС
-: количество теплоты, соответствующее изменению температуры единицы массы вещества на 1 ОС
+: количество теплоты, соответствующее изменению температуры единицы количества вещества на 1 К
-: количество теплоты, соответствующее изменению температуры единицы объема вещества на 1 ОС
I:
S: Теплоемкость…..
-: является функцией состояния
-: не зависит от условий, при которых определяется величина С = δQ / dТ.
+: является функцией процесса
-: количество теплоты, соответствующее изменению температуры единицы объема вещества на 1 ОС
I:
S: Удельная теплоемкость СУД............
-: является функцией состояния
-: количество теплоты, необходимое для нагревания единицы массы
(1 кг, 1 г) вещества на 1 ОС
+: количество теплоты, необходимое для нагревания единицы массы
(1 кг, 1 г) вещества на 1 К.
-: количество теплоты, соответствующее изменению температуры единицы объема вещества на 1 ОС
I:
S: Молярная теплоемкостьСМОЛ ……..
-: является функцией состояния
-: количество теплоты, необходимое для нагревания единицы массы (1 кг, 1 г) вещества на 1 ОС
+: количество теплоты, необходимое для нагревания 1 моль вещества на 1 К.
-: количество теплоты, необходимое для нагревания 1 моль вещества на 1 ОС
I:
S: Связь между С МОЛ и С УД ……
-: они является функциями состояния
-: С МОЛ = С УД / М
+: С МОЛ = С УД • М
-: С МОЛ = М / С УД
I:
S: Истинная молярная теплоемкость ….…
-: является функцией состояния
-: это отношение теплоты, необходимой для нагревания 1 моль вещества, к температуре
+: это отношение бесконечно малого количества теплоты, необходимого для нагревания 1 моль вещества, к бесконечно малому приращению температуры, которое при этом наблюдается
-: это отношение бесконечно малого количества теплоты, необходимого для нагревания 1 кг вещества, к приращению температуры, которое при этом наблюдается
I:
S: Разность между теплоемкостями  мала для..............
мала для..............
-: твердых тел
-: жидких тел
+: твердых и жидких тел
-: газов
I:
S: Разность между теплоемкостями  существенна для..............
существенна для..............
-: твердых тел
-: жидких тел
-: твердых и жидких тел
+: газов
I:
S: Взаимосвязь между СР и СV для 1 моль идеального газа выражается уравнением………
-: СР + СV = R
-: СР = СV
-: СV - СР = R
+: СР - СV = R
I:
S:. Соотношение СР и СV для газов……
-: изобарная теплоемкость газов СР иногда больше изохорной теплоемкости СV на величину R – универсальной газовой постоянной
-: изобарная теплоемкость газов СР всегда равна изохорной теплоемкости СV
-: изобарная теплоемкость газов СР не всегда больше изохорной теплоемкости СV на величину R – универсальной газовой постоянной
+: изобарная теплоемкость газов СР всегда больше изохорной теплоемкости СV на величину R – универсальной газовой постоянной
I:
S: Молярная теплоемкость сложных веществ в кристаллическом состоянии равна сумме молярных теплоемкостей входящих в них элементов - это…
-: закон Дальтона
-: Закон Кирхгоффа
-: правило Дюлонга и Пти
+: правило Коппа и Нейманна
I:
S: Теплоемкость твердых тел при постоянном объеме не зависит от температуры и равна 6 кал/(моль•К), или 25,12 Дж/(моль•К) = 3R. - это……
-: закон Дальтона
-: Закон Кирхгоффа
+: правило Дюлонга и Пти
-: правило Коппа и Нейманна
I:
S: Зависимость теплоты реакции от температуры определяется изменением теплоемкости системы в результате протекания реакции - это………
-: закон Дальтона
+: Закон Кирхгоффа
-: правило Дюлонга и Пти
-: правило Коппа и Нейманна
I:
S: Уравнение  является математическим выражением закона ………
является математическим выражением закона ………
-: Дальтона
+: Кирхгоффа
-: Дюлонга и Пти
-: Коппа и Неймана
I:
S: Формула DНТ2 = DНТ1 + DСр(Т2 –Т1) является упрощенным видом ………
-: закона Дальтона
+: закона Кирхгоффа
-: правила Дюлонга и Пти
-: правила Коппа и Нейманна
I:
S: Математическое выражение 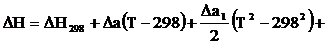
 является развернутым уравнением ………
является развернутым уравнением ………
-: Дальтона
+: Кирхгоффа
-: Дюлонга и Пти
-: Коппа и Нейманна
I:
S: Смысл второго начала термодинамики состоит в том, что ………
-: любой самопроизвольный процесс протекает в направлении, при котором система из менее вероятного (менее упорядоченного) состояния переходит в более вероятное (более упорядоченное)
+: любой самопроизвольный процесс протекает в направлении, при котором система из менее вероятного (более упорядоченного) состояния переходит в более вероятное (менее упорядоченное)
-: любой самопроизвольный процесс протекает в направлении, при котором система из более вероятного (менее упорядоченного) состояния переходит в менее вероятное (более упорядоченное)
-: любой самопроизвольный процесс протекает в направлении, при котором система из менее вероятного (более упорядоченного) состояния не переходит в более вероятное (менее упорядоченное)
I:
S: Смысл второго начала термодинамики состоит в том, что ………
-: самопроизвольному протеканию процесса не способствует увеличение неупорядоченности в системе
+: самопроизвольному протеканию процесса способствует увеличение неупорядоченности в системе
-: самопроизвольному протеканию процесса способствует уменьшение неупорядоченности в системе
-: самопроизвольному протеканию процесса способствует увеличение упорядоченности в системе
I:
S: Энтропия (S)………
-: не характеризует меру неупорядоченности системы
+: характеризует меру неупорядоченности системы
-: не является термодинамической функцией состояния
-: не связана с термодинамической вероятностью системы
I:
S: Для изолированных систем процессы, для которых изменение энтропии отрицательно,………
-: не запрещены
+: запрещены
-: наиболее вероятны
-: возможны
I:
S: Для изолированной системы второе начало термодинамики наиболее просто формулируется так……….
-: не возможны лишь такие (реальные) процессы, которые ведут к увеличению энтропии
+: возможны лишь такие (реальные) процессы, которые ведут к увеличению энтропии
-: возможны лишь такие (реальные) процессы, которые не ведут к увеличению энтропии
-: возможны лишь такие (реальные) процессы, которые ведут к уменьшению энтропии
I:
S: Неравенству Клаузиуса ∆S ≥ 0 соответствует утверждение……….
-: не возможны лишь такие (реальные) процессы, которые ведут к увеличению энтропии
+: возможны лишь такие (реальные) процессы, которые ведут к увеличению энтропии
-: возможны лишь такие (реальные) процессы, которые не ведут к увеличению энтропии
-: возможны лишь такие (реальные) процессы, которые ведут к уменьшению энтропии
I:
S: Для изолированной системы в равновесном состоянии энтропия системы……..
-: минимальна
+: максимальна
-: имеет среднее арифметическое значение
-: имеет отрицательное значение
I:
S: Математическое выражение второго начала (закона) термодинамики ….
-: 
+: 
-: 
-: 
I:
S: Утверждение, которое не является формулировкой второго начала термодинамики……..
-: Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому
+: В изолированных системах самопроизвольно могут протекать только процессы, не сопровождающиеся увеличением энтропии
-: Невозможен процесс, единственным результатом которого является превращение теплоты в работу
-: Невозможно построить машину, все действия которой сводились бы к производству работы за счет охлаждения теплового источника (вечный двигатель второго рода)
I:
S: Утверждение, которое не является формулировкой третьего начала термодинамики……..
-: При абсолютном нуле температуры свободная энергия X равна теплоте процесса
+: В изолированных системах самопроизвольно могут протекать только процессы, не сопровождающиеся увеличением энтропии
-: При температурах, близких к абсолютному нулю, теплоемкость системы равна нулю
-: Энтропия идеального кристалла при абсолютном нуле температуры равна нулю
I:
S: Тепловая теорема Нернста и постулат Планка позволяют рассчитывать……
-: тепловой эффект реакции.
+: абсолютную энтропию системы
-: энтальпию процесса
-: внутреннюю энергию процесса
V18. Термодинамические функции, общие условия равновесия систем.
I:
S: Функция состояния 
-: изобарно-изотермический потенциал G (функция состояния, называемая энергией Гиббса)
+: изохорно-изотермический потенциал (свободная энергия Гельмгольца)
-: максимальная полезная работа (максимальная работа за вычетом работы расширения)
-: внутренняя энергия системы
I:
S: 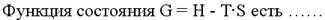
+: изобарно-изотермический потенциал G (функция состояния, называемая энергией Гиббса)
-: изохорно-изотермический потенциал (свободная энергия Гельмгольца)
-: теплосодержание системы
-: внутренняя энергия системы
I:
S: Условие, которое не является необходимым для самопроизвольного протекания процесса в закрытых системах. ……
+: ΔH = 0
-: ΔG < 0, dG < 0
-: ΔF < 0, dF < 0
-: нет правильного ответа
I:
S: При экзотермической реакции в закрытой термодинамической системе ……
+: 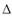 H < 0
H < 0
-: 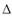 H = 0
H = 0
-: 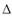 H > 0
H > 0
-: 
I:
S: При эндотермической реакции в закрытой термодинамической системе ……
-: ΔH < 0
-: ΔH = 0
+: ΔH > 0
-: 
I:
S: При экзотермической реакции в закрытой термодинамической системе ……
+: 
-: 
-: 
-: 
I:
S: При эндотермической реакции в закрытой термодинамической системе ……
-: 
-: 
+: 
-: 
I:
S:

+: самопроизвольно
-: в обратном направлении
-: не самопроизвольно
-: с поглощением тепла
I:
S:

+: ΔН > TΔS
-: ΔН < TΔS
-: dU = δQ - δА
-: Q = ∆U + А
I:
S:

+: ΔН < TΔS
-: ΔН > TΔS
-: ΔН < T / ΔS
-: ΔН > T / ΔS
I:
S:

+: невозможно
-: возможно
-: обратимо
-: необратимо
I:
S:

+: уменьшением свободной энергии системы
-: увеличением свободной энергии системы
-: уменьшением энтальпии системы
-: увеличением энтальпии системы
I:
S: Невозможность протекания самопроизвольного процесса в закрытой термодинамической системе характеризуется ……
-: уменьшением свободной энергии системы
+: увеличением свободной энергии системы
-: уменьшением энтальпии системы
-: увеличением энтальпии системы
I:
S: Условием термодинамического равновесия в закрытой системе является……
+:минимальное значение соответствующего термодинамического потенциала
-:максимальное значение соответствующего термодинамического потенциала
-: минимальное значение работы
-: максимальное значение работы
I:
S: Условием термодинамического равновесия в закрытой системе является……
+: ΔG = 0, ΔF = 0
-: ΔG >0, ΔF >0
-: ΔG < 0, ΔF < 0
-: 
I:
S: Термодинамическим равновесием называется такое термодинамическое состояние системы…..
+: которое при постоянстве внешних условий не изменяется во времени
-: которое при постоянстве внешних условий изменяется во времени
-: которое при непостоянстве внешних условий не изменяется во времени
-: которое при непостоянстве внешних условий изменяется во времени
I:
S: Отношение бесконечно малого изменения величины свободной энергии системы к бесконечно малому количеству компонента, внесенному в систему, есть…..
+: химический потенциал μi данного компонента в системе
-: энтальпия данного компонента в системе
-: энтропия данного компонента в системе
-: теплосодержание данного компонента в системе
I:
S: Какое утверждение не соответствует понятию химический потенциал (µ)…….
+: (µ) не является функцией состояния и значение его зависит от температуры, давления (или объема) и концентрации
-: (µ) это величина, которая определяет изменение внутренней энергии системы, связанной с изменением массы (m) входящих в нее компонентов
-: (µ) есть функция, определяющая направление и предел самопроизвольного перехода данного компонента из одной фазы в другую при соответствующих превращениях
-: (µ) является ф
 2018-01-21
2018-01-21 329
329







