1. Сформулируйте основной закон химической кинетики - закон действующих масс. Приведите его математическое выражение (уравнение) для: а) элементарной реакции и б) для данной изучаемой реакции. Чем отличаются эти уравнения? Как называются?
2. Какую количественную зависимость устанавливает закон действующих масс: v = f(?)? Назовите и охарактеризуйте каждую из величин, входящих в кинетическое уравнение дл простой (элементарной) реакции.
Действующих масс закон, один из основных законов физической химии; устанавливает зависимость скорости химической реакции от концентраций реагирующих веществ и соотношение между концентрациями (или активностями) продуктов реакции и исходных веществ в состоянии химического равновесия. Норвежские учёные К. Гульдберг и П. Вааге, сформулировавшие Д. м. з. в 1864—67, назвали "действующей массой" вещества его количество в единице объёма, т. е. концентрацию, отсюда — наименование закона.
Если в идеальной газовой смеси или идеальном жидком растворе происходит реакция:
аА + а'А' = bB + b'B' (1)
(А, А' и т.д. — вещества, а, а' и т.д. — стехиометрические коэффициенты), то, согласно Д. м. з., скорость реакции в прямом направлении:
r+ = k+ [A] a [A'] a' (2)
3. Что называют константой скорости реакции? Каков физический смысл этой величины? От каких факторов зависит значение константы скорости? Какова ее размерность? Как обычно определяют константы скоростей? С какой целью это делается?
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Для бимолекулярных реакций типа vAA+vBB: продукты, протекающих при постоянном объеме, согласно действующих масс закону,
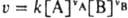
где vA и vB - стехиометрич. коэф. реагирующих веществ А и В, k - константа скорости; численно k=v при [А]=[В]=1 моль/л. Для мономолекулярных реакций К. с. имеет размерность с-1, для бимолекулярных - л/моль.с, для тримолекулярных - л2/моль2.с. Помимо истинной К. с. часто имеют дело с эффективной К. с. kэфф в рассматриваемом эксперименте; если, например, бимолекулярная реакция между А и В происходит при большом избытке вещества В и концентрация [В] практически не меняется, кинетич. ур-ние реакции м.б. записано в виде:
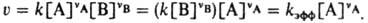
4. Дайте определение понятиям:
· порядок реакции по реагенту (частный порядок),
· порядок реакции в целом (общий порядок),
· молекулярность химической реакции.
Какие численные значения могут принимать эти величины? В каком случае эти величины могут быть равны? Как на основе этих понятий классифицируют химические реакции?
От чего зависит порядок реакции по реагенту? В каком случае значения порядка реакции по каждому реагенту совпадает со стехиометрическими коэффициентами в химическом уравнении реакции? О чем свидетельствует несоответствие между значениями этих величин?
Влияние температуры.
1. Каким правилом выражается зависимость скорости химической реакции от температуры v = f(t0C)? Что называют температурным коэффициентом скорости реакции? Какие он может иметь значения для обычных химических реакций?
Зависимость скорости реакции от температуры предложил Аррениус:
Уравнение Аррениуса в дифференциальной форме:
Зависимость константы скорости от температуры в нешироком интервале температур в большинстве случаев подчиняется уравнению:
d lnk/dT=E/RT2
где k – константа скорости химической реакции;
T – температура, K;
E – константа, которая называется энергией активации
химической реакции, Дж/моль.
После интегрирования (при условии, что E = const) уравнение легко привести к виду:
Уравнение Аррениуса в интегральной форме
k=Ae-Ea/RT
где k-константа скорости реакции
e - основание скорости логарифма
Ea – энергия активации
R-универсальная газовая постоянная
T- температура по шкале Кельвина
А-коэф-т пропорциональности
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции, числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10°С. Температурный коэффициент различных реакций различен.
При обычных температурах его значение для большинства реакций находится в пределах от 2... 4.
2. Напишите математическое выражение правила Вант-Гоффа, которое показывает, что влияние температуры на скорость химической реакции связано с изменением константы скорости реакции. Охарактеризуйте каждую из входящих в выражение величин.
Скорости большинства химических реакций повышаются с ростом температуры. Для некоторых реакций в области умеренных температур выполняется эмпирическое правило Вант-Гоффа, согласно которому:
Правило Вант-Гоффа:
при повышении температуры на 10 градусов скорость
реакции увеличивается в 2 – 4 раза:
Kt+m*10/KТ= γm
где Kt,Kt+m*10– константы скорости при температуре T и повышен-
ной в m раз на 10 градусов температуре T + 10⋅m,
γ – температурный коэффициент реакции (γ ≈2÷4).
3. Перечислите основные положения теории активных столкновений и дайте определения и иллюстрации следующим понятиям:
· энергия активации реакции,
· энергетическая диаграмма реакции с указанием величины энергии активации данной реакции,,
· переходный (активный) комплекс,
· активные молекулы.
Основные положения теории активных столкновений:
· Протекание реакции обусловлено столкновениями между реагирующими частицами
· Каждое столкновение может приводить к реакции только в том случае, если ее энергия превосходит некоторую min энергию
· Каждое столкновение приводит к реакции, если сталкивающиеся частицы определенным образом ориентированны одна по отношению к другой
Концентрация и теория столкновений
· Скорость хим. реакции обычно возрастает при увеличении концентрации одного или нескольких реагентов
· В случае гетерогенных реакций, скорость будет определяться частотой столкновений реагирующих частиц на границе раздела двух сред
Энергия активации реакции - минимальное количество энергии, которое требуется сообщить системе, чтобы произошла реакция, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Энергетическая диаграмма реакции с указанием величины энергии активации данной реакции:
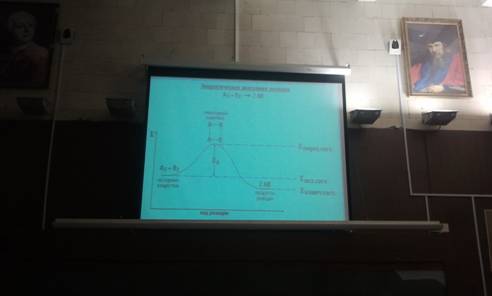
Переходный (активный) комплекс - критическая конфигурация, которую имеют молекулы в момент достижения максимума энергии
Активные молекулы - частицы, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга.
4. Покажите схематически распределение молекул в газовой системе по энергиям при разных температурах (распределение Максвелла-Больцмана). Какие выводы можно сделать на основании этого распределения?
5. Что представляет собой уравнение Аррениуса? Напишите его математическое выражение и объясните, между какими кинетическими характеристиками реакции устанавливает зависимость это уравнение? Что следует из этого уравнения? Как можно экспериментально определить значение энергии активации данной реакции?
Уравнение Аррениуса - температурная зависимость константы скорости к элементарной химической реакции:
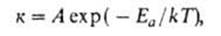
где A-предэкспоненциальныи множитель, Еа -энергия активации, Т-абс. температура, k-постоянная Больцмана.
Согласно микроскопич. кинетич. интерпретации Аррениуса уравнения, наличие предэкспоненц. множителя А обусловлено равновесным максвелл-больцмановским распределением реагирующих частиц, а Также тем, что зависимость вероятности р-ции от энергии Е этих частиц имеет пороговый характер. Последнее означает, что вероятность р-ции начинает быстро возрастать, как только Е достигает нек-рой величины Е0. В такой ситуации к выражается уравнением, в котором Еа заменено на Eo, а А является ф-цией т-ры. Следовательно, Аррениуса уравнение-аппроксимация температурной зависимости истинной константы скорости в ограниченном температурном интервале.
Для определения необходимо построить график. График представляет собой кривую линию; если его используют для определения величин А и Еа, необходимо указывать соответствующие концентрационный и температурный интервалы.
6. Нарисуйте энергетическую диаграмму обратимой химической реакции. У кажите на диаграмме величины энергий активации для прямой и обратной реакций соответственно. Одинаковы или различны константы скоростей прямой и обратной реакции? Как они будут изменяться при увеличении температуры?
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
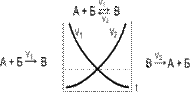
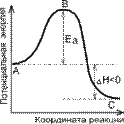
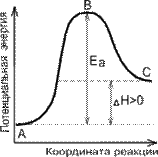
Дельта H-энергия активации.
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2).
Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
 2018-01-21
2018-01-21 672
672








