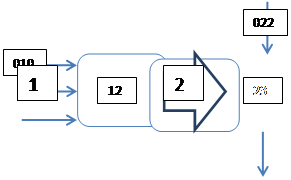
5.1 Блок-схема:

 |  | ||||
 | |||||
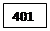




 | |||
 |
Блоки: 1 – синтез, 2 – закалка, конденсация, абсорбция, 3 – разделение органической и водной фаз, 4 – промывка;
Потоки:
010 –этилен
011 –хлороводород
012 –кислород
12 – реакционные газы
022 – вода в абсорбер
201 – хлороводород водный
23 – конденсат на разделение
301 – водная фаза
34 – раствор на промывку (органическая фаза)
042 – раствор щелочи
401 – 1,2-дихлорэтан
402 – водный раствор, непр. NaOH, NaCl, гидрат глиоксалевой кислоты
5.2 Допущения расчета материального баланса:
· С целью упрощения расчетов в качестве побочных реакций рассматривают только образование хлораля.
· Конверсия этилена принимается равной 100%.
· Считаем, что раствор, выходящий из промывной колонны содержит гидрат глиоксалевой кислоты, хлорид натрия, гидроксид натрия и воду.
Табл. 1. Исходные данные.
| Показатель | Значения |
| Конверсия HCl, % | 99,0 |
| Селективность, % | 98,0 |
| Содержание NaOH в промывном растворе, % (по массе) | 5,0 |
| Избыток NaOH по отношению к стехиометрическому | 5,0 |
| Концентрация HCl в растворе, выходящем из абсорбера, % (по массе) | 15,0 |
| Базис расчета, кг 1,2-дихлорэтана на выходе из промывной колонны |
Основная реакция:
CH2=CH2 + 2HCl + 0,5О2 → СН2Сl-СН2Сl + Н2О (1)
Побочная реакция:
CH2=CH2 + 3HCl + 2О2 → Сl3С-СНO + 3Н2О (10)
Удаление хлораля:
Cl3C-CHO + 3NaOH = 3NaCl + (HO)2CHCOOH (11)
«Базисные» уравнения по дихлорэтану и хлоралю (первый блок):

Масса поступающего хлороводорода:



Масса непрореагировавшего хлороводорода:


Масса поступающего кислорода:

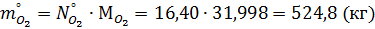
Масса прореагировавшего кислорода:


Масса непрореагировавшего кислорода:

Масса поступающего этилена:
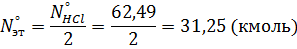

Масса воды, поступившей в абсорбер:

Масса воды, образовавшейся в результате реакций (1) и (10):


Масса образовавшегося хлораля:


Масса поступившей щелочи:
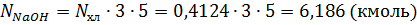

Масса непрореагировавшей щелочи:

Масса воды, поступившей со щелочью:

Масса образовавшегося хлорида натрия:

Масса образовавшегося гидрата глиоксалевой кислоты:

5.3 Технологические показатели
Выход ДХЭ по этилену:

Расходные коэффициенты:
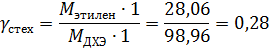

Селективность ДХЭ по хлороводороду:

Селективность ДХЭ по этилену:

Селективность ДХЭ по кислороду:

Табл. 2. Материальный баланс окислительного хлорирования этилена.
| Приход | Расход | ||||
| Название | Масса, кг | % | Название | Масса,кг | % |
| HCl | 
| 26,03 | ДХЭ | 34,25 | |
| Этилен | 
| 10,01 | HCl | 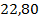
| 0,26 |
| O2 | 
| 6,00 | Вода: | ||
| Вода, поступившая в абсорбер | 
| 1,48 | Поступившая в абсорбер | 
| 1,48 |
| Раствор NaOH на промывку: | Получившаяся в результате реакций | 
| 6,50 | ||
| NaOH | 
| 2,82 | Из раствора щелочи | 4700,6 | 53,66 |
| Вода | 
| 53,66 | Гидрат глиоксалевой к-ты | 37,96 | 0,43 |
| NaCl | 72,45 | 0,83 | |||
| O2 | 13,5 | 0,15 | |||
| NaOH | 197,9 | 2,26 | |||
| Всего | 8758,9 | Всего | 8742,8 | 99,82 | |
| невязка | 16,1 | 0,18 |
5.4 Поточная диаграмма синтеза 1,2-дихлорэтана:
В блоке разделения происходит разложение на две фазы: оргническую и неорганическую, водную. 1,2-дихлорэтан обладает небольшой растворимостью в воде (0,88г/100мл, что эквивалентно 0,87%мас) так же, как и вода обладает небольшой растворимостью в ДХЭ (0,16%мас).
Для определения количеств ушедших во время разделения ДХЭ и воды составим систему уравнений, приняв массу ушедшего ДХЭ за X, а ушедшей воды - за Y.




 Масштаб: 1см=1000кг
Масштаб: 1см=1000кг



 | |||
 | |||


 |



 | |||
 |

 |

 |

 |

 |

 |

 |
6. Список используемой литературы:
· Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1975. – 734 с.
· Тимофеев В.С., Серафимов Л.А. Принципы технологии основного органического и нефтехимического синтеза. – М.: Высш. шк., 2003. – 536 с.
· Журнал. Успехи современного естествознания. – 2014. - № 9 (часть 1) – С. 162-163.
· Ильичева О.Е., Федченко С.В. Ядовитые технические жидкости. Методическая разработка. – Челябинск, 2011.
· Муганлинский Ф.Ф., Трегер Ю.А., Люшин М.М. Химия и технология галогенорганических соединений. – М.: Химия, 1991.
· Флид М. Р. Винилхлорид: химия и технология. В 2-х кн. Кн. 1 / М. Р. Флид, Ю. А. Трегер. – М.: Калвис, 2008. – 584 с.
 2018-01-21
2018-01-21 523
523






