Целью работы является определение молекулярного веса кислорода. Определение молекулярного веса кислорода проводится на приборе, изображённом на рисунке 1:
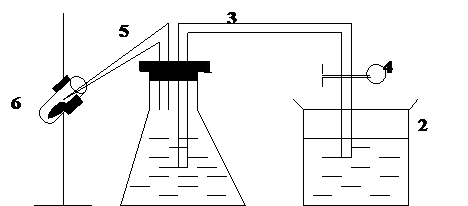
Рисунок 1 – Прибор для определения молекулярного веса кислорода: 1 - колба с водой; 2 - химический стакан; 3 - сифон; 4 - зажим; 5 - стеклянная трубка; 6 - тугоплавкая пробирка.
Собрать прибор по рисунку 1. Колбу 1 залить водопроводной водой. В стакан 2 налить 50 мл воды. Заполнить сифон водой. Для этого через трубку 5 вдуть воздух в прибор при открытом зажиме 4, и, когда сифон заполнится водой, закрыть зажим 4.
В сухую пробирку 6 насыпать около 1 г перманганата калия. Пробирку с содержимым взвесить на аналитических весах с точностью до 0,01 г. Проверить герметичность. Опустить конец сифона в стакан 2.
Открыв зажим 4, начать разложение соли, нагревая пробирку 6 слабым пламенем газовой горелки. Нагревание следует проводить весьма осторожно, периодически приближая и удаляя горелку от пробирки. При этом реакция разложения должна протекать не слишком интенсивно. В результате нагревания произошла следующая реакция:
2KMnO4=K2MnO4+MnO2+O2↑
Когда в стакан 2 перекачалось примерно 100-150 мл воды, прекратить нагревание, дать прибору охладится до комнатной температуры, после чего снова взвесить.
Измерить объём вытесненной воды в стакане (из измеренного количества вычесть ранее добавленные 50 мл воды). Объём воды равен объёму полученного кислорода при температуре опыта.
Определить вес полученного кислорода по разности веса пробирки до и после опыта.
Ход работы и наблюдения свели в таблицу 1.
Расчётная часть.
Таблица 1 – Результаты расчетов и наблюдений
| № п/п | Наименование параметра | Ед. измерения | Результат |
| Масса пробирки с содержимым до нагревания | г | 18,2 | |
| Масса пробирки с содержимым после нагревания | г | 18,0 | |
| Масса выделившегося кислорода | г | 0,2 | |
| Объём воды в стакане после опыта | мл | ||
| Объём воды в стакане до опыта | мл | ||
| Объём вытесненной воды, равный объёму выделившегося кислорода в условиях опыта | мл | ||
| Объём кислорода приведённый к нормальным условиям | мл | 134,6 | |
| Температура воздуха в лаборатории | 0С | ||
| Атмосферное давление | кПа | 101,1 | |
| Давление водяных паров при температуре опыта | кПа | 3,17 | |
| Давление кислорода в колбе | кПа | 97,93 |
Объём кислорода приведенный к нормальным условиям, выделившегося во время опыта, находим по формуле:
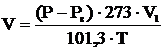
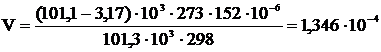 м3
м3
Молекулярную массу определяем по формуле Клайперона-Менделеева.
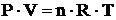 ; так как
; так как 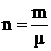 ;
;
Подставим в искомое уравнение получим:
 ; отсюда
; отсюда 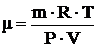 ;
;
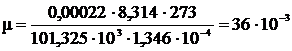

Вычислим процент ошибки по формуле:
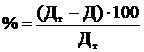
где  - теоретические данные газа,
- теоретические данные газа,
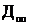 - опытные данные газа.
- опытные данные газа.
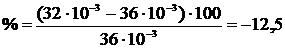 %
%
Вопросы и задачи.
1 Методы расчёта молекулярных масс при н.у. и условиях отличных от нормальных.
Если вещество находится в газообразном состоянии, то его молекулярную массу можно найти с помощью закона Авогадро. По закону Авогадро равные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержат равное число молекул. Отсюда следует, что массы двух газов, взятых в одинаковых объемах, должны относится друг к другу, как их молекулярные массы.

где 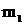 ,
, 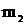 - массы первого и второго газов,
- массы первого и второго газов,
 ,
, 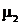 - молекулярные массы первого и второго газов.
- молекулярные массы первого и второго газов.
Исходя из этой формулы находят молекулярную массу газа.
Часто молекулярная масса различных газов определяется по отношению к водороду, как самому легкому из всех газов.
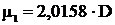
или, если округлить молекулярную массу водорода до2:
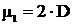
где D – относительная плотность газа
Нередко также молекулярную массу газа вычисляют, исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же можно говорить о средней молекулярной массе воздуха, определенной из плотности воздуха по водороду. Обозначим плотность исследуемого газа по воздуху через Dвозд, получим следующее уравнение для вычисления мольных масс:
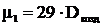
2 Вычислить какой объём (н.у.) займёт 1 г H2, CH4, NO2, NO, NH3, O3.
| Дано: | Решение: |
Р=101,325∙103 Па Т=273 К m=0,001 кг μ(H2)=2∙10-3  μ(CH4)=16∙10-3 μ(CH4)=16∙10-3  μ(NO2)=56∙10-3 μ(NO2)=56∙10-3  μ(NO)=30∙10-3 μ(NO)=30∙10-3  μ(NH3)=17∙10-3 μ(NH3)=17∙10-3  |  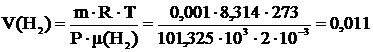 м3 м3  м3 м3  м3 м3 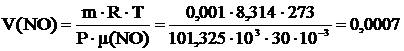 м3 м3 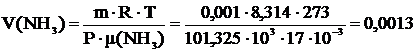 м3 м3 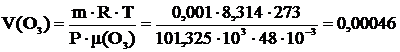 м3 м3 |
μ(O3)=48∙10-3  | |
| V -? |
3 Вычислить массу 1 м3 газов (н.у.) N2O, SiF4, SO2.
| Дано: | Решение: |
V=1 м3 Р=101,325∙103 Па Т=273 К μ(N2O)=44∙10-3  μ(SiF4)=104∙10-3 μ(SiF4)=104∙10-3  μ(SO2)=64∙10-3 μ(SO2)=64∙10-3  |  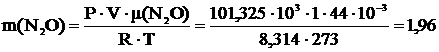 кг кг 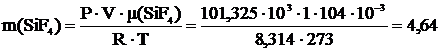 кг кг 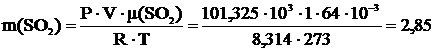 кг кг |
| m -? |
4 Масса 200 мл ацетилена (н.у.) равна 0,232 г. Вычислить молекулярную массу ацетилена.
| Дано: | Решение: |
| V=200∙10-6 м3 m=0,232∙10-3 кг Р=101,325∙103 Па Т=273 К |  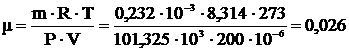  |
| μ -? |
5 Вычислить массу азота, содержащегося в баллоне ёмкостью 20 л при Р=80 атм и t=250С.
| Дано: | Решение: |
V=20∙10-3 м3 Р=8106∙103 Па Т=298 К μ=28∙10-3  |  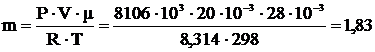 кг кг |
| m -? |
6 Масса 87 мл пара при t=620C и Р=758 мм.рт.столба равна 0,24 г. Вычислить молекулярную массу азота.
| Дано: | Решение: |
| V=87∙10-6 м3 m=0,24∙10-3 кг Р=101∙103 Па Т=335 К |    |
| μ -? |
7 Вычислить массу 1 м3 воздуха при t=170C, P=624 мм.рт.столба; массу 1 м3 СО2 при t=270C и Р=1 атм.
а)
| Дано: | Решение: |
| V=1 м3 Р=83,19∙103 Па Т=290 К |  |
μ=29∙10-3  | 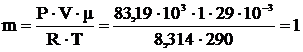 кг кг |
| m -? |
б)
| Дано: | Решение: |
V=1 м3 Р=101,325∙103 Па Т=300 К μ=44∙10-3  |  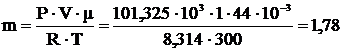 кг кг |
| m -? |
8 Вычислить объём, который займёт при t=170C и Р=1 атм. 1 кг воздуха.
| Дано: | Решение: |
Р=101,325∙103 Па Т=290 К m=1 кг μ=29∙10-3  |  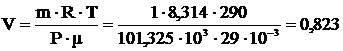 м3 м3 |
| V -? |
9 Масса 20 мл газа (н.у.) равна 0,0268 г. Вычислить молекулярную массу газа.
| Дано: | Решение: |
| V=20∙10-6 м3 m=0,0268∙10-3 кг Р=101,325∙103 Па Т=273 К |  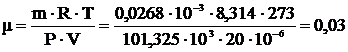  |
| μ -? |
10 Вычислить, какие газы тяжелее или легче воздуха: NO2; CO; Cl2; NH3; NO; F2 и во сколько раз.
| Дано: | Решение: |
| V=1 м3 Р=101,325∙103 Па |  |
Т=273 К μ(NO2)=46∙10-3  μ(CO)=28∙10-3 μ(CO)=28∙10-3  μ(Cl2)=71∙10-3 μ(Cl2)=71∙10-3  μ(NH3)=17∙10-3 μ(NH3)=17∙10-3  μ(NO)=30∙10-3 μ(NO)=30∙10-3  μ(F2)=38∙10-3 μ(F2)=38∙10-3  |  кг кг  кг кг 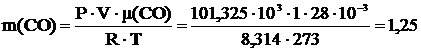 кг кг 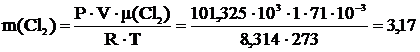 кг кг  кг кг 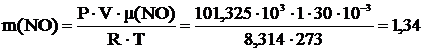 кг кг 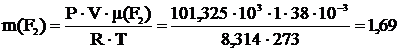 кг кг 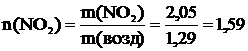  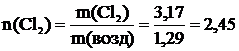 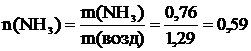 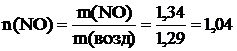 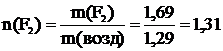 |
| m -?, n -? | |
Вывод: Определение молекулярной массы кислорода производится по формуле Клайперона-Менделеева, необходимыми параметрами для этого являются объем выделившегося в реакции кислорода, масса кислорода, температура и давление. Измеренные в результате опыта параметры приводим к нормальным условиям, точность метода зависит от точности измерения массы и объема.
 2018-01-21
2018-01-21 3330
3330






