Теоретическую основу современной химии составляет атомно-молекулярное учение.
Атомы – мельчайшие химические частицы, являющиеся пределом химического
разложения любого вещества.
Химический элемент представляет собой вид атомов с одинаковым положительным
зарядом ядра.
Следовательно, атом – это наименьшая частица химического элемента,
сохраняющая все его химические свойства. В настоящее время известно 110
элементов, из которых 92 встречаются в природе.
В зависимости от природы частиц, из которых построено вещество, различают
вещества с молекулярной и немолекулярной структурой. Практически все
органические вещества (т.е. подавляющее большинство известных веществ)
состоят из молекул. Среди неорганических соединений молекулярное строение
имеют примерно 5%. Таким образом, наиболее типичной формой существования
вещества является молекула.
Молекула – наименьшая частица вещества, способная существовать самостоятельно
и сохраняющая его основные химические свойства.
При обычных условиях вещества с молекулярной структурой могут находиться в
твердом, жидком или газообразном состоянии. Вещества с немолекулярной
структурой находятся только в твердом состоянии, преимущественно в
кристаллической форме. Носителями химических свойств таких веществ являются
не молекулы, а комбинации атомов или ионов которые образуют данное вещество.
Символическая запись простейшего численного соотношения, в котором атомы
различных элементов образуют химическое соединение, называется формулой.
Следовательно, формула выражает определенный (качественный и количественный)
состав соединения. Так, SO2, N2, CO - формулы веществ, имеющих молекулярное
строение. Их состав всегда строго постоянен. NaCl, AlF3, ZnS– формулы веществ,
не имеющих молекулярное строение при обычных условиях. Состав таких веществ не
всегда постоянен и часто зависит от условия их получения. Отклонение от
целочисленного соотношения могут быть выражены при записи формулы: Fe0,9S,
TiO0,7, ZrN0,69. Вещества с постоянным составом называются дальтонидами,
вещества с переменным составом – бертоллидами.
Массы атомов химических элементов чрезвычайно малы. В химии пользуются не их
абсолютными значениями, а относительными.
Относительной атомной массой химического Ar элемента называется величина,
равная отношению средней массы атомов данного элемента (с учетом процентного
содержания его изотопов в природе) к 1\12 массы изотопов углерода – 12.
1\12 массы атома изотопа углерода 12 принята за атомную единицу массы
(а. е. м.), международное обозначение - u.
Относительная атомная масса является величиной безразмерной.
Относительной молекулярной массой Mr вещества называется отношение массы его
молекулы к 1\12 массы атома изотопа углерода 12.
Поскольку большинство неорганических веществ при обычных условиях не имеют
молекулярного строения, в данном случае можно говорить о формульной массе
F, понимая под ней сумму атомных масс всех элементов, входящих в
соединение, с учетом числа атомов каждого элемента в формуле.
Единицей измерения количества вещества n (ν) в Международной системе единиц
является моль.
Моль – количество вещества, содержащее столько структурных элементарных
единиц (атомов, ионов, молекул, электронов, эквивалентов и т.д.), сколько
содержится атомов в 0,012 кг изотопа углерода 12.
Число атомов NA в 0,012 кг углерода (т.е. в 1моль) легко определить, зная массу
атома углерода. Точное значение этой величины – 6,02·10²³. Эта
величина называется постоянной Авогадро и является одной из важнейших
универсальных постоянных. Она равна числу структурных единиц в 1 моль любого
вещества.
Масса 1 моль вещества Х называется молярной массой М(Х) и представляет
собой отношение массы m этого вещества к его количеству n.
Закон сохранения массы: «Масса веществ, вступивших в химическую реакцию,
равна массе веществ, образовавшихся в результате реакции, с учетом массы,
соответствующей тепловому эффекту реакции». Он был сформулирован великим
русским ученым М.В.Ломоносовым в 1748г. и подтвержден экспериментально им самим
в 1756г. и независимо от него французским химиком А.Л.Лавуазье в 1789г.
Закон постоянства состава вещества: «Любое сложное вещество молекулярного
строения независимо от способа получения имеет постоянный количественный
состав».
Закон Авогадро: «В равных объемах различных газов при одинаковых условиях
содержится одно и то же количество молекул».
Следствия: 1. Если число молекул некоторых газов равно, то при н.у.
они занимают равные объемы. Если же число молекул равно
6,02·10²³, то объем газа равен 22,4 л. Этот объем называется
молярным объемом.
1. Абсолютная плотность газа равна отношению его молекулярной массы к
молярному объему
2. Относительная плотность газа (Х) по другому газу (Y) равна отношению
молярной массы газа (Х) к молярной массе газа (Y).
Уравнение Клаперона:
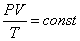 | 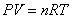 | 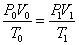 | |||
Уравнение Менделеева-Клаперона:
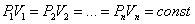 |
Уравнение Шарля-Гей-Люсака:
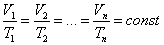 |
 2015-07-14
2015-07-14 1714
1714
