Детерминация Эмбриональная индукция


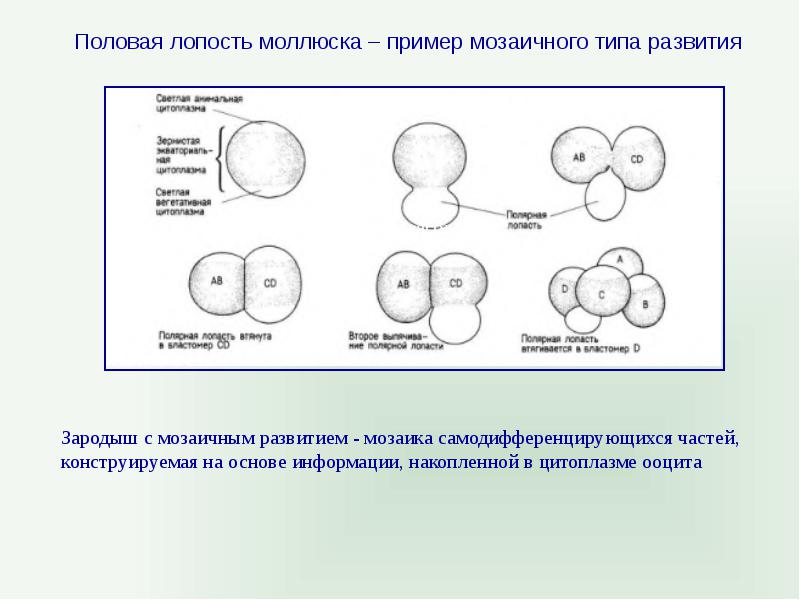

Регуляционное развитие

Вегето-анимальные градиенты

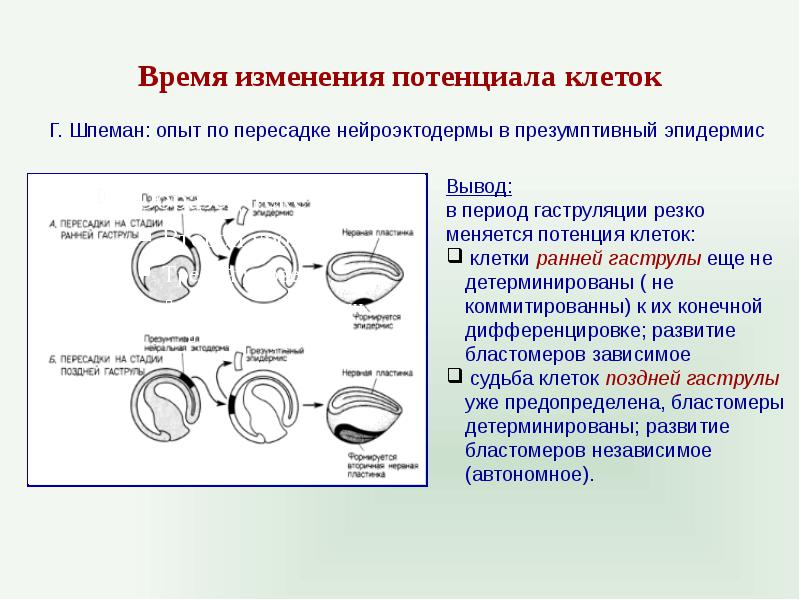
Время изменения потенциала клеток
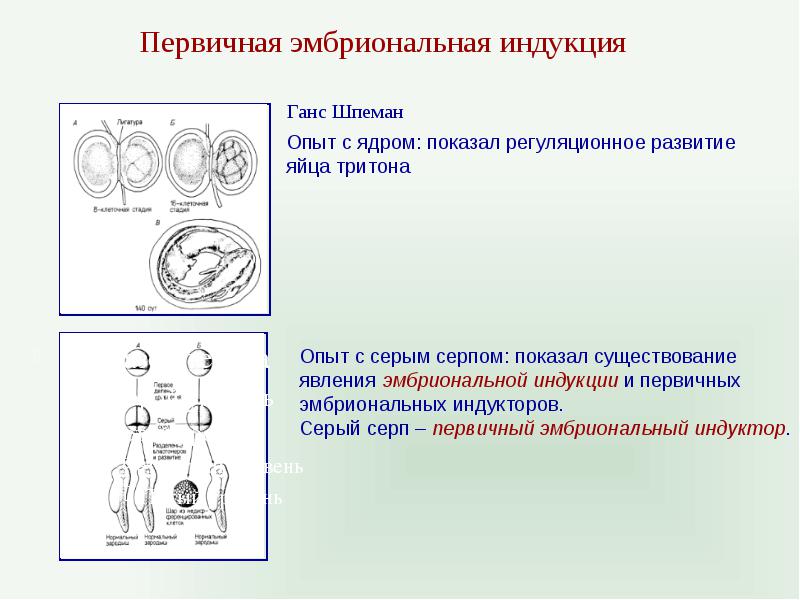
Первичный организатор

Опыты Тунга и Тунга

Компетенция

Региональная специфичность эмбрионального индуктора

Цитоплазматическая локализация детерминантов

Компас посвящен развитию стволовых клеток, типам стволовых клеток, процессам в организме (invivo) и исследованиям в лабораториях (invitro)
ЕЩЕ РАЗ О СТВОЛОВЫХ КЛЕТКАХ
Стволовые клетки- основа самоподдержания организма. Благодаря им организм развивается, а затем и поддерживает популяцию клеток на нужном уровне, но с возрастом их становится меньше, они хуже функционируют, поэтому необходимо их введение в организм. Стволовые клетки- самая популярная тема для научных исследований. Ученые используют не только эмбриональные стволовые клетки, но и даже нашли способы перепрограммирования соматических клеток в стволовые.

Стволовые клетки - это аппарат обновления, смены устаревших <больных> клеток, в том числе для защиты от преждевременного старения. Стволовые клетки открывают огромные перспективы для лечения тяжелых неизлечимых заболеваний, таких как диабет, заболевания сердечно-сосудистой системы, нейродегенеративные заболевания и др. возраст- ассоциированные заболевания. Возможно, с их помощью будет найдено лекарство от старения.
В организме пролиферация и дифференцировка стволовых клеток- сложный многоэтапный процесс. В рассмотрении этого вопроса был частично использован материал монографииРепина В.С., Ржаниновой А.А., Шаменкова Д.А.
|
|
|
ИССЛЕДОВАНИЯ И БИОЭТИКА

В настоящее время ЭСК нужны не только для расшифровки кодов пред- и постимплантационного развития, но и лабораторного воспроизводства клеток органов в обход беременности. Получить миниорганыinvitro - более трудная задача, чем получить дифференцированные клетки тех же органов. Клетки -дублёры зиготы необходимы длябиоэтически допустимых экспериментов. ЭСК не являются зародышем, не имеют статуса <новой жизни>, поскольку получены в обход оплодотворения и беременности. Сохраняя ранг клеток, ЭСК являются чем-то большим:они серийно копируют органогенез. Они незаменимы для изучения стыков развития клетка-орган-ткань. Пока наука не имеет достаточных аргументов, чтобы окончательно определить юридический и биоэтический статус ранних зародышей, эмбрионов и плодов. Отсутствие законодательной базы относительно всех периодов жизни человека существенно влияет на принятие практических решений в области репродукционного и терапевтического клонирования. Идеи биоэтики во многих высокоразвитых странах, утверждающих статус новой жизни и личности с момента зачатия и появления зиготы, идут вразрез с принятым законодательством, признающим права новой жизни лишь с момента рождения. Согласование этих вопросов на уровне государств и международных институтов (ООН, Совет Европы и т.п.) имеет
первостепенное значение для свободного развития биологии и медицины. Как известно, права на новые исследования и знания могут быть ограничены, если человек или зародыш не становятся средством в руках других людей.
|
|
|
В этическом (на и в научном) аспекте проблемы интересны последние новости, которые облетели весь мир. За месяц до голосования в Палате общин относительно нового законодательства, регулирующего научно-исследователь скую деятельность, в Великобритании были впервые созданы эмбрионы, сочетающие человеческий и животный материал. Ученые университета Ньюкасл вчера сообщили об успешном создании смешанного эмбриона посредством внедрения человеческой ДНК в яйцеклетки коровы. Это первый эксперимент такого рода в Великобритании. В Ньюкасле цибриды (цитоплазматические гибриды) прожили три дня, и самый большой из них дорос до 32 клеток. Общественность (в особенности люди религиозные) были возмущены.
ЭМБРИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ

Все начинается с эмбриональных стволовых клеток (ЭСК). Они являются "дублерами" зиготы и обладают свойством тотипотентности, т.е. из них затем могут образоваться все клетки и ткани организма. После первых некольких делений стволовые клетки становятся плюрипотентными (т.е. они могут затем давать начало некоторым, а не всем, клеточным линиям), а затем и мультипотентными (т.е. родоначальниками нескольких клеточных линий).
Подобно зиготе и первым клеткам зародыша, ЭСК в условиях культуры воспроизводят <лабораторный> эмбриогенез в два этапа. Сначала микрограммовые количества "клеток безфенотипа" пассируют (выращивают) в миллиарды клеток. Затем незрелые постмитотические клетки с помощью набора химических инструкций invitro (в пробирке) видоизменяют в клетки мозга, сердечной, скелетной мышцы, печени и т.п.
ЭСК обладают рядом свойств:
1) Тотипотентность - способность образовывать любую из 350 тканей организма;
2) Хоуминг - способность cтволовых клеток, при введении их в организм, находить зону повреждения и фиксироваться там, исполняя утраченную функцию;
3) Факторы, которые определяют уникальность cтволовых клеток находятся не в ядре, а вцитоплазме. Это избыток мРНК всех 3 тысяч генов, которые отвечают за раннее развитие зародыша;
4) Теломеразная активность. При каждом делении часть теломер утрачивается (предел Хейфлика), но в стволовых (а также в опухолевых и половых) клетках теломераза достраивает теломеры, делая клетки бессмертными.
ЭСК - незаменимая модель для функциональнойпостгеномики. Кардиомиоциты, миоциты, клетки крови и иммунной системы являются полными автоматами. Поведение ЭСК определяется взаимодействием внешних сигналов с эпигеномной системой клеток, имеющих уникальный набор белков и предсинтезированныхмРНК. На клетках ЭСК с максимально простым фенотипом легче анализировать главный алгоритм онтогенеза. Адекватный выбор сигналов и ответы ЭСК доказывают, что клетки имеют системы для распознания, выбора сигналов, их селективной переработки. Селективный отбор сигналов преобразуется далее в паттерны (образы) поведения клеток. Поведение клеток и его нарушение является конечной целью современной медицины. Этот уровень знаний дает новые инструменты для разгадок болезней и старения.
Другая важная особенность генома ЭСК- спонтанная частота мутаций ниже в несколько раз, чем у соматических клеток. Внутрихромосомная рекомбинация и редупликация отдельных сегментов хромосом полностью блокированы устройством хроматина. Генетическая нестабильность хромосом и анеуплоидия в пассажах характерны только для линий тератокарциномы (эмбриональный рак, тератокарцинома - тератобластома, состоящая из недифференцированных эпителиальных элементов, формирующих железистоподобные сосочковые и солидные структуры) и эмбриокарциномы (Cervantes R.B., Stringer J.R., Tischfield J.A.,2002).Эта особенность организации хроматина делает маловерятными случайные перестройки хромосом, связанные с малигнизацией трансплантированных ЭСК-дериватов.
|
|
|
Cтволовая ниша - стабильное микроокружение вокруг каждого клона ЭСК, создаваемое монослоем так называемых "фидерных клеток". Трофобласт служит фидером для эмбриобластаупредимплантационных зародышей млекопитающих. Клетки хориоидного сплетения служат питательной, защитной и информационной средой для нейральных стволовых клеток эпендимыразвивающегося мозга. Эндотелиальные синусы, либо капиллярная сеть служат нишей для региональных стволовых клеток органов и тканей, в том числе для мезенхимальных стволовых клеток. По этой причине все ранние ЭСК зародыша выращивают в суспензии над монослоем фидерных стромальных клеток, которые обеспечивают незрелые плюрипотентные клетки всем необходимым для выживания и самообновления.
ТОТИ-, ПЛЮРИ - И МУЛЬТИПОТЕНТНЫЕ КЛЕТКИ

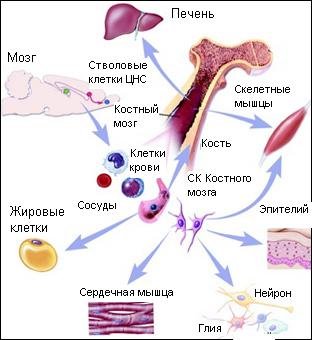
В зародыше и взрослом организме потенции генома стволовых клеток существенно варьируют по "ассортименту" фенотипа специализированных клеток. Более ранние, тотипотентные ЭСК дифференцируются в любую из 250 линий специализированных клеток органов. Необходимо подчеркнуть, что ЭСК invitro не продуцируют клеток трофобласта, плаценты, т.е. потенции генома ЭСК меньше зиготы. Соответственно биологический статус ЭСК меньше статуса раннего зародыша. Плюрипотентные ЭСК дают более ограниченный спектр фенотипов. Например, мезенхимальные стволовые клетки (МСК), локализованные в опорно-сосудистом каркасе (строме) органов, дифференцируются в культуре только в клетки хряща, кости, кардиомиоциты и миоциты. Монопотентные стволовые клетки (мышц, жировой ткани, периферических нервов) созревают до одного преобладающего фенотипа клеток. Стволовые региональные клетки взрослого организма наделены мультипотентностью- пластичной плюрипотентностью, которая сильно варьирует в контексте органа-реципиента (т.е. в зависимости от набора внутритканевых регулирующих факторов).

Так, пересадки гематогенных стволовых клеток в мозг, сердечную или скелетную мышцу приводили к образованию ткане-специфичных ростков донорской ткани в органах реципиента. Большое внимание уделяется сейчас мультипотентнымМСК взрослых органов, поскольку эти клетки хорошо мигрируют и многократно химеризуют ткани. В свою очередь, пересадки нейрональных стволовых клеток в печень, мышцу или иммунную систему сопровождались тканеспецифичной перестройкой фенотипа донорских клеток. Хорошо доказано, что сигналы микроокружения играют решающую роль в судьбе трансплантированных ЭСК/МСКinsitu. Схема развития МСК:

Существенно, что ЭСК/ МСК при дифференцировке в культуре давали лишь "природные" линии дифференцированных клеток, которые встречались в организме взрослого животного и человека. Никаких новых типов клеток или неизвестных линий дифференцированных клеток из ЭСК не возникало invitro. Наблюдения подтверждены другими многочисленными работами, что снижает риск осложнений и повышает безопасность клеточной терапии дериватами стволовых клеток.
|
|
|
ПЛЮРИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ В ЭМБРИОНЕ
СТВОЛОВЫЕ КЛЕТКИ ВО ВЗРОСЛОМ ОРГАНИЗМЕ
ВЫРАЩИВАНИЕ ЭСК IN VITRO

Для исследователей ЭСК- это пособие для расшифровки работы генома (особенно в период раннего эмбриогенеза и органогенеза). Необходимо напомнить, что изучение эмбриогенеза человека ограничено по биоэтическим соображениям. Постимплантационный эмбриогенез млекопитающих мышей, крыс, других лабораторных млекопитающих имеет существенные отличия. Во многих ситуациях ЭСК остаются единственной экспериментальной возможностью для моделирования событий, происходящих в зародыше человека после имплантации. Таким образом, ЭСК человека и млекопитающих - незаменимый путь для изучения аномалий постимплантационного развития зародышей. А самое главное, ЭСК- незаменимое средство поиска лекарства против старения.
Для ЭСК характерно два варианта запрограммированного поведения в культуре:
1) незрелые ЭСК длительно размножаются в присутствии фидерного слоя клеток и ростовых факторов.
2) после наработки массы недифференцированных клеток, рамножение клеток останавливают, изменяя условия культивирования. Начинается дифференцировка клеток (желательно в один тип специализированных клеток).
ЭСК назвали "лабораторными лошадками" регенерации (Petit-Zeman, 2001), потому что регенерация органов практически невозможна за счет резерва собственных дифференцированных клеток. ЭСК сохраняются insitu ("на месте") и повторяют фрагменты эмбриогенеза в тканях взрослого организма. Некоторые линии ЭСК человека удавалось пассировать без изменения фенотипа более 2 лет. Такие культуры прошли 300-450 циклов удвоения клеток без возникновения анеуплоидии или опухолей. При устранении фидера, ростовых факторов, а также после добавления сигналов начиналась медленная многоэтапная дифференцировка ЭСК в популяции необратимо специализированных клеток. Интересно, что дифференцировка ЭСК в нейроны, кардиомиоциты идет за 10-15 дней, тогда как аналогичные процессы линейного созревания клеток в эмбрионе идут 5-7 нед (Kawasaki H., Suemori H., Mizuseki K. et al.,2002). В последнее время стали использовать сигналы фидерного слоя клеток для ускоренной дифференцировки клеток в культуре.
Рост ЭСК в культуре идет клонами. В отличие от обычного экспоненциального размножения клеток в культуре, клон не растет, а самообновляется. Только в клоне сохраняется микроокружение, позволяющее стволовым клеткам удерживать необычно высокую генетическую потенцию. Эта особая геномика клеток сохраняется и воспроизводится только в плотной сфере. Каждая культура ЭСК имеет варьирующую долю клеток в суспензионных агрегатах (сферах). Одиночные клетки, покидая клон, неизбежно дифференцируются. Лишь агрегаты составляют суммарное пространство плюрипотентных клеток, остальные клетки специализируются под влиянием микроокружения. Большинство новых фенотипов возникает по периферии клонов. В каждом клоне клетки одновременно дифференцируются в разные фенотипы, подтверждая важность микроокружения.
Известно, что в первичной культуре эмбриобласта (эпибласта) обязательно сохраняют первичные агрегаты клеток при получении линий ЭСК (Talbot N.C., Carrett W.M., 2001) Одноклеточные суспензии эпибласта/эмбриобласта зародышей человека и обезьяны практически не выживали в первичной культуре. Внешние слои клона более активно пролиферировали в среде с ростовыми факторами (LIF, SCF, IL-6, bFGF, EGF,TGF-alpha). Состав и оптимальные концентрации факторов пролиферации подбираются эмпирически в каждой культуре. Более продвинутые клетки по периферии сфер гибли в селективной среде, предназначенной для выживания наименее зрелых популяций. Когда клеточные агрегаты достигали размера 30-50 клеток, наступало равновесие между пролиферацией и апоптозом. Каждый клон - это микромодуль самообновления клеток в постоянномминиобъеме. Репертуар прогениторных клеток постоянно меняется без изменения самого стволового пространства. Провизорные клоны сменяются дефинитивными клетками за счет множественных циклов самообновления клеток. Спонтанную дифференцировку и гибель клеток предотвращали повторным диспергированием агрегатов. Клоногенность - это способность культуры генерировать разную численность клон-инициирующих клеток на мл. Пока клоногенность существующих линий находилась на уровне 1-2 % (Pera M.F., 2001). Сигналы, запускающие инициацию клонов, практически не изучены. Выявлены варианты ЭСК, в которых исходно экспрессированы разные наборы генов, отвечающих за два главных качества клона: 1) плюрипотентность генома 2) самообновление прогениторных клеток (Morrison S.J., Shah N.M., Anderson D.J.,1997).
Сравнительный анализ показал, что линии ЭСК человека имеют существенные отличия от ЭСК животных по набору параметров: выживаемость и чувствительность к разным условиям культивирования, зависимость от митогенов и факторов апоптоза, факторов цитодифференцировки и сигналов, контролирующих функциональное созревание и поведение клеток invitro (Carpenter M.K., Inokuma M.S., Denham J. etal., 2001). Поэтому данные, получаемые на ЭСК мышей, с большими оговорками экстраполируются на человека. Исследования генома плюрипотентных клеток животных, включая эффект лекарств, имеют сигнальное, но не решающее значение, особенно в областях прикладной медицины. Здесь нужны прямые эксперименты на ЭСК человека.
ВСЕ, ЧТО ВЫ ХОТЕЛИ ЗНАТЬ О СТВОЛОВЫХ КЛЕТКАХ, НО БОЯЛИСЬ СПРОСИТЬ
МИГРАЦИЯ ПРОГЕНИТОРНЫХ КЛЕТОК В ТИМУС И РАЗВИТИЕ Т-КЛЕТОК

Старение тесно связано с изменениями иммунной системы. В связи с этим необходимы исследования стволовых клеток- предшественников клеток иммунитета.
Развитие Т-клеток уникально по сравнению с другими клетками крови, т.к. оно заканчивается не в костном мозге, а в тимусе. Тимус не содержит факторов самоподдержаниядлительноготимопоэза (гемопоэза в тимусе). Введение тимоцитов внутривенно или в тимус вызывает кратковременное возобновление тимопоэза. Долговременныйтимопоэз можно достичь только с помощью внутривенного введения прогениторных клеток костного мозга. Эти и другие результаты показывают, что тимопоэз зависит от клеток-предшественников из костного мозга. Пока клетки, которые мигрируют с током крови и оседают в тимусе, еще не идентифицированы. Предполагается, что они редки и меют более короткое время полу-жизни, чем другие прогениторные клетки в циркуляторном русле и костном мозге. Непохоже, что любые клетки костного мозга, оседая в тимусе, могут участвовать в тимопоэзе. Гораздо более вероятным кажется, что существует одна популяция клеток костного мозга, которая, попадая в тимус, участвует в тимопоэзе. Этому посвящена недавно вышедшая статья исследовательской группы в составе Sambandam A, Bell JJ, Schwarz BA, Zediak VP, Chi AW, Zlotoff DA, Krishnamoorthy SL, Burg JM, Bhandoola A из Университета Пенсильвании под названием "Миграция прогениторных клеток в тимус и развитие Т-клеток". Ученые считают, что подобные исследования помогут в борьбе с раком и старением иммунной системы. Возможно, с помощью них будут преодолены возрастные дефекты иммунитета.
СТАРЕНИЕ И ГЕМОПОЭЗ

Как уже говорилось выше, старение затрагивает все системы, в том числе и систему гемопоэза. Это вопросу посвящен недавний обзор ученых из ImmuneDiseaseInstitute HarvardMedicalSchool.
Возрастные изменения гемопоэза приводят к анемии, снижению адаптивной способности иммунитета, развитию миелогенных заболеваний- все это приводит к нарушению гомеостаза. Гомеостаз тканей и органов у взрослых определяется преимущественно активностью стволовых и прогениторных клеток. Это было согласуется с тем, что дисбаланс, сопровождающий старение системы гемопоэза, может происходить из-за изменений распространения и/или функциональных свойств гемопоэтических стволовых клеток (HSCs) и прогениторных клеток.
На этой проблеме сконцентрирован интерес многих ученых по всему миру.
СТВОЛОВЫЕ КЛЕТКИ И НЕЙРОДЕГЕНЕРАТИВНЫЕ ЗАБОЛЕВАНИЯ

Один из самых страшных признаков старения-нейродегенеративные заболевания. Они характеризуются патологическими изменениями или апоптозом нейронов, составляющих сети. Это отрицательно сказывается на физиологических функциях. С увеличением численности пожилых людей в обществе увеличивается и процент заболевших нейродегенеративными заболеваниями. Успехи в биологии стволовых клеток дали надежду на нахождение эффективной терапии для таких больных. С недавнего времени стволовые клетки используются для лечения нейродегенеративных заболеваний на животных моделях. О перспективах применения стволовых клеток в терапии нейродегенеративных заболеваний можно прочитать встатье китайских ученых из Университета Пекина.
РЕГЕНЕРАЦИЯ МЫШЕЧНОЙ ТКАНИ

С возрастом мышцы атрофируются, слабеют. Происходит саркопения- гибель мышечных клеток восполняется все хуже, в итоге их становится меньше. Это последствие старения значительно ухудшает качество жизни пожилых людей, наряду с возраст- зависимыми заболеваниями.
Исследовательская группа из UniversityofTexasHealthScienceCenter под руководством профессора Sun опубликовала статью "Клетки костного мозга и регенерация скелетных мышц", в которой подробно рассказывается о процессе восстановления мышечной ткани с помощью стволовых клеток.
Регенерация конечности требует координированного взаимодействия популяций мультипотентных стволовых клеток для возпроизведения процесса формирования ткани. Регенерация скелетных мышц регулируется клетками костного мозга, это было показано на мышах с недостатком CC-хемокинового рецептора 2 (CCR2). Размер мышечного волокна, число миогенных прогениторных клеток (MPCs) и участие клеток костного мозга и макрофагов были оценены  после кардиотоксин-индуцированного повреждения химерных мышей (их получали пересадкой костного мозга из организмов дикого типа (WT) или с недостатком хемокинового рецептора CCR2(-)(/)(-)-мышей в облученных WT- или CCR2(-)(/)(-)-мышей-хозяев). Невзирая на генотип хозяев, регенерация мышц и участие клеток костного мозга и макрофагов было схожим у мышей с пересаженным костным мозгом дикого типа, кроме того, накопелние клеток из костного мозга и макрофагов снижалось и регенерация мышц была недостаточной у мышей, получивших костный мозг с фенотипом CCR2(-)(/)(-). Более того, число MPCs было повышенным, а размер мышечных волокон сниженным у мышей CCR2(-)(/)(-). Был сделан вывод о том, что экспрессия CCR2 на клетках из костного мозга регулирует вовлечение макрофагов в регенерацию поврежденной мышцы, число MPC и размер регенерируещего мышечного волокна, независимо от экспрессии CCR2 в клетках хозяина. Ученые надеются продолжить исследования в данном направлении, возможно они помогут улучшить качество жизни пожилых людей.
после кардиотоксин-индуцированного повреждения химерных мышей (их получали пересадкой костного мозга из организмов дикого типа (WT) или с недостатком хемокинового рецептора CCR2(-)(/)(-)-мышей в облученных WT- или CCR2(-)(/)(-)-мышей-хозяев). Невзирая на генотип хозяев, регенерация мышц и участие клеток костного мозга и макрофагов было схожим у мышей с пересаженным костным мозгом дикого типа, кроме того, накопелние клеток из костного мозга и макрофагов снижалось и регенерация мышц была недостаточной у мышей, получивших костный мозг с фенотипом CCR2(-)(/)(-). Более того, число MPCs было повышенным, а размер мышечных волокон сниженным у мышей CCR2(-)(/)(-). Был сделан вывод о том, что экспрессия CCR2 на клетках из костного мозга регулирует вовлечение макрофагов в регенерацию поврежденной мышцы, число MPC и размер регенерируещего мышечного волокна, независимо от экспрессии CCR2 в клетках хозяина. Ученые надеются продолжить исследования в данном направлении, возможно они помогут улучшить качество жизни пожилых людей.
СТАРЕНИЕ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ

Эпидемиологические исследования показали, что возраст- главный фактор риска для возникновения атеросклеротических заболеваний сердечно-сосудистой системы, но молекулярные механизмы увеличения риска с возрастом остаются неясными. Исследованиемэтихвопросовзанимаютсяученыеиз Department of Cardiovascular Science and Medicine, Chiba University Graduate School of Medicine. В своей статье "Старение сосудов: клеточное старение, старение столовых клеток и синдромы преждевременного старения" они делают обзор достижений науки в этой области.
Многие данные свидетельствуют о том, что системы репарации сердечно-сосудистой системы с возрастом работают хуже, что индуцирует возникновение возраст-зависимой сердечной недостаточности. Это ухудшение сопровождает старение сердечной ткани на клеточном уровне как результат укорочения теломер, повреждения ДНК, нестабильности генома. Репликативная способность клеток сердца и сосудов, в особенности стволовых и прогениторных клеток, снижается с возрастом. В понимании процессов старения сердечно-сосудистой системы внесли особый вклад прогрессивные исследования синдромов преждевременного старения, которые характеризуются в том числе и старение сердечно-сосудистой системы. Большинство генов участвуют в метаболизме ДНК, мутировавшие формы этих генов участвуют в изменениях ответа на повреждение ДНК и снижении пролиферации клеток- это главные характеристики старения сердечно-сосудистой системы. В будущем эти исследования помогут в борьбе со старением и с главной причиной смертности во всем мире- сердечно-сосудистыми заболеваниями.
В ЗАКЛЮЧЕНИЕ

Стволовые клетки-неиссякаемая тема для научных исследований. Сколько секретов они таят, сколько пользы они могут принести человечеству. Пролиферация и дифференцировка стволовых и прогениторных клеток invivo (в организме) и invitro (в лабораторных условиях)- это сложные, многоэтапные и до конца не исследованные процессы. По всему миру созданы десятки институтов, сотни, если не тысячи, лабораторий и исследовательских групп для изучения стволовых клеток. Это вселяет надежду на сорую победу над тяжелыми неизлечимыми возраст-зависимыми заболеваниями и старением. Уже многое известно, но есть много вопросов, на которые предстоит ответить, в том числе:
1) каков точный и подробный механизм пролиферации и дифференцировки стволовых клеток?
2) как происходит старение стволовых клеток?
3) как преодолеть старение стволовых клеток?
4) можно ли широко использовать стволовые клетки для лечения возраст-зависимых заболеваний не только на животных моделях, но и для человека?
5) безопасно ли это?
6) каковы перспективы клеточной терапии?
По этим и многим другие вопросы среди ученых нет единого мнения, предстоит еще немало исследований. Может быть уже скоро люди будут жить дольше и лучше.
В литературе накопилось значительное количество сообщений, в которых изложены результаты изучения нейрональной дифференцировки эмбриональных стволовых клеток.
К настоящему времени получены различные линии эмбриональных стволовых клеток и разработаны методы для достаточно эффективной индукции дифференцировки в нейрональные и глиальные клетки. Так, частота спонтанной дифференцировки эмбриональных стволовых клеток линии BLCb в нейроны достигала 15-30%. После стимулирования ретиноевой кислотой в низкой концентрации (10-7 М) выход нейронов достигал 100%.
Установлено соответствие между стадией зрелости нейронов и синтезом в них нейронспецифических белков. На ранней стадии индуцированногонейрогенезаэкспрессировались гены, кодирующие белки нейрофиламентов с низкой (NF-L) и средней (NFM) молекулярной массой, белоксинаптических пузырьков синаптофизин, потенциалзависимые ионные каналы. По мере созревания клеток увеличивалась плотность потенциалзависимых ионных каналов (Са2+, К+, Na-K-каналов), а с усилением активности генов — и содержание белков, свойственных зрелым нейронам.
Для обогащения культуры эмбриональных стволовых клеток производными, которые дифференцируются в определенном направлении, большое значение приобретают ростовые факторы или морфогены. Добавление их в культуру в определенной комбинации, также как и кокультивирование или котрансплантирование эмбриональных стволовых клеток с тканями или клетками — индукторами, имплантирование эмбриональных стволовых клеток в определенные органы или ткани (тканевое окружение индуцирует направленную дифференцировку) и другие подходы значительно приближают решение проблемы обогащения культур эмбриональных стволовых клеток дифференцирующимися предшественниками, в том числе и нейрональными.
 Так, К. Addicks et al. (1999) применяли метод проточной цитометрии для выявления флюоресценции производных эмбриональных стволовых клеток — нейронов и глии. Для этого ими была получена трансфицированная методом электропорации культура эмбриональных стволовых клеток мыши. Генетическая конструкция — ген зеленого флюоресцирующего белка (Greenfluorescentprotein — GFP) медузы Aquoreavictoria, который находился под контролем регулирующей последовательности второго интрона гена нестина — белка, синтезируемого наиболее ранними предшественниками нервных клеток. Все клетки, вступившие в нейрональную дифференцировку, при воздействии возбуждающим излучением с длиной волны 320 нм испускали зеленое свечение. Выделенные таким образом предшественники нервных клеток инъецировали (примерно 300 тыс.) в мозг крыс. Через 7 дней после этого в микросрезах мозга наблюдали локализацию флюоресцирующих клеток в месте инъекции, а также в окружающих тканях мозга. При этом клетки, экспрессирующие GFP, характеризовались нейроэпителиальной морфологией и иммунореактивностью к нестину. Кластеры нейрональных предшественников, дифференцированных в зрелые нейроны, обнаруживались даже через 4 недели после трансплантации в области инъекции.
Так, К. Addicks et al. (1999) применяли метод проточной цитометрии для выявления флюоресценции производных эмбриональных стволовых клеток — нейронов и глии. Для этого ими была получена трансфицированная методом электропорации культура эмбриональных стволовых клеток мыши. Генетическая конструкция — ген зеленого флюоресцирующего белка (Greenfluorescentprotein — GFP) медузы Aquoreavictoria, который находился под контролем регулирующей последовательности второго интрона гена нестина — белка, синтезируемого наиболее ранними предшественниками нервных клеток. Все клетки, вступившие в нейрональную дифференцировку, при воздействии возбуждающим излучением с длиной волны 320 нм испускали зеленое свечение. Выделенные таким образом предшественники нервных клеток инъецировали (примерно 300 тыс.) в мозг крыс. Через 7 дней после этого в микросрезах мозга наблюдали локализацию флюоресцирующих клеток в месте инъекции, а также в окружающих тканях мозга. При этом клетки, экспрессирующие GFP, характеризовались нейроэпителиальной морфологией и иммунореактивностью к нестину. Кластеры нейрональных предшественников, дифференцированных в зрелые нейроны, обнаруживались даже через 4 недели после трансплантации в области инъекции.
Трансплантация чужеродных клеток индуцирует в организме донора Т-клеточный иммунный ответ. Однако в отношении трансплантации нейральных предшественников проблема не стоит остро, так как благодаря гематоэнцефалическому барьеру мозг надежно защищен от влияния клеточного иммунитета хозяина. Кроме того, в этих опытах не наблюдалось неконтролируемой пролиферации и опухолевого роста в месте введения клеток. Предлагается для исключения возможности образования опухолей использовать «гены-самоубийцы», например, ген тимидинкиназы вируса герпеса-1, который убивает клетку при ее малигнизации.
N. Benvenistyetal. (2001) подтвердили данные В. Reubinoffetal. о способности эмбриональных стволовых клеток человека давать начало зрелым нейронам, которые экспрессируют легкую цепь нейрофиламента NF-L (белок, выявляемый в незрелых и зрелых нейронах), тяжелую цепь нейрофиламента NF-H (характерный для зрелых нейронов), допаминовые рецепторы (ДДС). Ретиноевая кислота и β-фактор роста нервов увеличивают соответственно количество нейрональных клеток, которые образуются из эмбриональных стволовых клеток человека с 212 (контроль) до 52 % И 39 %. В культуре нейроны формировали переплетения нейрональных отростков и различной сложности «нейрональную сетку». Можно сделать вывод, что появилась возможность получения неограниченного количества зрелых нейронов человека в культуре.
Синтетические силикаты состоят из простых или сложных солей кремниевой кислоты и широко используются в различных коммерческих и промышленных приложениях, таких как пищевые добавки, стекло, керамические материалы-наполнители и вещества, препятствующие слеживанию.
«На фоне старения населения США количество травм и дегенеративных заболеваний постоянно увеличивается», – говорит руководитель исследования Али Хадемхоссейни (AliKhademhosseini), PhD. «Как результат, существует повышенный спрос на методы лечения, способные восстановить поврежденные ткани. В частности, существует большая потребность в новых материалах, направляющих дифференцировку стволовых клеток и стимулирующих образование функциональных тканей. Силикатные нанопластинки обладают потенциалом удовлетворить эту потребность медицины и биотехнологий».
Ученые собираются продолжить исследования, чтобы разобраться в лежащих в основе этого феномена путях, определяющих благоприятный ответ клеток. Это поможет понять, как наиболее эффективно использовать новую стратегию для дальнейшего усовершенствования различных терапевтических конструкций, и в конечном итоге сократить время выздоровления пациентов.
 Силикатныенанопластинки индуцируют дифференцировку стволовых клеток в костные, что определяется по образованию костного матрикса (красный).
Силикатныенанопластинки индуцируют дифференцировку стволовых клеток в костные, что определяется по образованию костного матрикса (красный).
(Фото:Khademhosseini lab)
«Основываясь на серьезных предварительных исследованиях, мы считаем, что чрезвычайно биологически активные нанопластинки могут быть использованы для разработки устройств, таких как инъецируемые матрицы для восстановления тканей, биологически активные наполнители или терапевтические средства для стимуляции специфического клеточного ответа, в инженерии костных тканей», – говорит АхилешГахарвар (AkhileshGaharwar), первый автор статьи.
 2018-01-21
2018-01-21 1057
1057






