Атомная единица массы (обозначение а. е. м.), она же дальтон (обозначение Da), — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. Атомная единица массы выражается через массу нуклида углерода 12C и равна 1/12 массы этого нуклида.
1 а. е. м. ≈ 1,660 540 2(10)·10−27 кг = 1,660 540 2(10)·10−24 г
Моль — единица измерения количества вещества в Международной системе единиц (СИ), одна из семи основных единиц СИ.
Число́ Авогадро, константа Авогадро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как N A.
Валентность — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентнакатиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях.
|
|
|
В результате работ И. В. Рихтера был открыт закон эквивалентов:
· все вещества реагируют и образуются в эквивалентных отношениях.
· формула, выражающая Закон эквивалентов: m1Э2=m2Э1
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
Сн=nэквивалента/Vраствора - нормальная концентрация (нормальность)
6. Опыт Резерфорда. Планетарная модель строения атома Нагаоки-Резерфорда. Атомное ядро, характеристики. Нуклоны. Изотопы. Изобары. Электродинамическая несостоятельность планетарной модели. Спектроскопия. Представление о физике электромагнитного поля. Атомные спектры излучения. Квантовая концепция стационарных состояний атома. Соотношение Планка. Постоянная Планка.
Используя естественный источник радиоактивного излучения, Резерфорд построил пушку, дававшую направленный и сфокусированный поток частиц. Пушка представляла собой свинцовый ящик с узкой прорезью, внутрь которого был помещен радиоактивный материал. Благодаря этому частицы (в данном случае альфа-частицы, состоящие из двух протонов и двух нейтронов), испускаемые радиоактивным веществом во всех направлениях, кроме одного, поглощались свинцовым экраном, и лишь через прорезь вылетал направленный пучок альфа-частиц. Далее на пути пучка стояло еще несколько свинцовых экранов с узкими прорезями, отсекавших частицы, отклоняющиеся от строго заданного направления. В результате к мишени подлетал идеально сфокусированный пучок альфа-частиц, а сама мишень представляла собой тончайший лист золотой фольги. В нее-то и ударял альфа-луч. После столкновения с атомами фольги альфа-частицы продолжали свой путь и попадали на люминесцентный экран, установленный позади мишени, на котором при попадании на него альфа-частиц регистрировались вспышки. По ним экспериментатор мог судить, в каком количестве и насколько альфа-частицы отклоняются от направления прямолинейного движения в результате столкновений с атомами фольги.
|
|
|
В рамках устоявшейся модели атома полученный результат не мог быть истолкован: в сетке с изюмом попросту нет ничего такого, что могло бы отразить мощную, быструю и тяжелую альфа-частицу. Резерфорд вынужден был заключить, что в атоме большая часть массы сосредоточена в невероятно плотном веществе, расположенном в центре атома. А вся остальная часть атома оказывалась на много порядков менее плотной, нежели это представлялось раньше. Из поведения рассеянных альфа-частиц вытекало также, что в этих сверхплотных центрах атома, которые Резерфорд назвал ядрами, сосредоточен также и весь положительный электрический заряд атома, поскольку только силами электрического отталкивания может быть обусловлено рассеяние частиц под углами больше 90°.
· Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
· Планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
Атомное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что в более чем в 10 тысяч раз меньше размеров самого атома.
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным  и связанным с ним магнитным моментом.
и связанным с ним магнитным моментом.
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
|
|
|
Заряд:  , где
, где 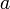 и
и  — постоянные,
— постоянные,  - количество протонов.
- количество протонов.
Радиус:  , где
, где  — константа,
— константа,  - полное количество нуклонов в ядре.
- полное количество нуклонов в ядре.
Масса: В ядерной физике массу ядер принято измерять в атомных единицах массы (а. е. м.), за одну а. е. м. принимают 1/12 часть массы нуклида 12C. Следует отметить, что стандартная масса, которая обычно приводится для нуклида — это масса нейтрального атома. Для определения массы ядра нужно из массы атома вычесть сумму масс всех электронов(более точное значение получится, если учесть еще и энергию связи электронов с ядром).
Энергия: 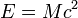 , где
, где  — скорость света в вакууме.
— скорость света в вакууме.
Изотопы — разновидности атомов (и ядер) какого-либохимического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа.
Изобары — нуклиды разных элементов, имеющие одинаковое массовое число; например, изобарами являются 40Ar, 40K, 40Ca.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро.
Спектроскопия — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в том числе, электромагнитного излучения, акустических волн и др.) с веществом
Прямая задача спектроскопии — предсказание вида спектра вещества исходя из знаний о его строении, составе и прочем.
Обратная задача спектроскопии — определение характеристик вещества (не являющихся непосредственно наблюдаемыми величинами) по свойствам его спектров (которые наблюдаются непосредственно и напрямую зависят как от определяемых характеристик, так и от внешних факторов).
Атомные спектры, оптические спектры, получающиеся при испускании или поглощении электромагнитного излучения свободными или слабо связанными атомами (например, в газах или парах). Являются линейчатыми, то есть состоят из отдельных спектральных линий, характеризуемых частотой излучения v, которая соответствует квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению: hv = Ei- Ek где h -постоянная Планка. Спектральные линии можно характеризовать также длиной волны  = c/v (с - скорость света), волновым числом
= c/v (с - скорость света), волновым числом  = v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1, длины волн - в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографической или фотоэлектрической регистрацией.
= v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1, длины волн - в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов - в эВ. Типичные атомные спектры наблюдаются в видимой, УФ- и ближней ИК-областях спектра. Спектры испускания, или эмиссионные, получают при возбуждении атомов различными способами (фотонами, электронным ударом и т.д.), спектры поглощения, или абсорбционные, - при прохождении электромагнитного излучения, обладающего непрерывным спектром, через атомарные газы или пары. Для наблюдения атомных спектров применяют приборы с фотографической или фотоэлектрической регистрацией.
|
|
|
Атомные спектры обладают ярко выраженной индивидуальностью: каждому элементу соответствует свой спектр нейтрального атома (так называемый дуговой спектр) и свои спектры последовательно образующихся положительных ионов (так называемые искровые спектры). Линии в этих спектрах обозначают римскими цифрами, например линии FeI, FeII, FeIII в спектрах железа соответствуют спектрам Fe, Fe+, Fe2+.
Вид спектра зависит как от электронного строения данного атома, так и от внешних условий - температуры, давления, напряженностей электрического и магнитного полей и т. п.
В атомных спектрах проявляются не все возможные квантовые переходы, а лишь разрешенные правилами отбора. Так, в случае атома с одним внеш. электроном разрешены лишь переходы между уровнями, для которых орбитальное квантовое число l изменяется на 1  , т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях могут быть рассчитаны методами квантовой механики.
, т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями (l = 2) и т.д. Количественная характеристика разрешенного оптического квантового перехода - его вероятность, определяющая интенсивность спектральной линии, соответствующей этому переходу. Вероятности переходов в простейших случаях могут быть рассчитаны методами квантовой механики.
Под влиянием внешних электрических и магнитных полей происходит расщепление спектральных линий. Возмущающие факторы, существующие в излучающей среде, вызывают уширение и сдвиг спектральных линий.
Исследования атомных спектров сыграли важнейшую роль в развитии представлений о строении атома.
При поглощении света атом переходит из стационарного состояния с меньшей энергией в стационарное состояние с большей энергией.
Поглощение света — процесс, обратный излучению. Атом, поглощая свет, переходит из низших энергетических состояний в высшие. При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие.
Постулаты Бора показали, что атомы "живут" по законам микромира.
Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
· Электрон в атоме, не теряя энергии, двигается по определённым дискретным круговым орбитам, для которых импульса квантуется:  , где
, где  — натуральные числа, а
— натуральные числа, а  — постоянная Планка. Пребывание электрона на орбите определяет энергию этих стационарных состояний.
— постоянная Планка. Пребывание электрона на орбите определяет энергию этих стационарных состояний.
· При переходе электрона с орбиты (энергетический уровень) на орбиту излучается или поглощается квант энергии 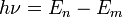 , где
, где  — энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается.
— энергетические уровни, между которыми осуществляется переход. При переходе с верхнего уровня на нижний энергия излучается, при переходе с нижнего на верхний — поглощается.
Постоянная Планка (квант действия) — основная константа квантовой теории, коэффициент, связывающий величину энергии кванта электромагнитного с его частотой так же, как и вообще величину кванта энергии любой линейной колебательной физической системы с её частотой. Связывает энергию и импульс с частотой и пространственной частотой, действия с фазой. Является квантом момента импульса. Впервые упомянута Планком в работе, посвящённой тепловому излучению, и потому названа в его честь. Обычное обозначение — латинское 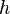 .
.
· 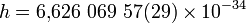 Дж·c
Дж·c
·  эрг·c.
эрг·c.
·  эВ·c.
эВ·c.
Часто применяется величина  :
:
·  Дж·c,
Дж·c,
· 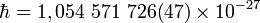 эрг·c,
эрг·c,
· 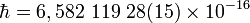 эВ·c,
эВ·c,
называемая редуцированной (иногда рационализированной или приведённой) постоянной Планка или постоянной Дирака. На 24-й Генеральной конференции по мерам и весам 17—21 октября 2011 года была единогласно принята резолюции, в которой, в частности, предложено в будущей ревизии Международной системы единиц переопределить единицы измерений СИ таким образом, чтобы постоянная Планка была равной точно 6,62606X·10−34 Дж·с, где Х заменяет одну или более значащих цифр, которые будут определены в окончательном релизе наосновании наиболее точных рекомендаций CODATA. В этой же резолюции предложено таким же образом определить как точные значения постоянную Авогадро, элементарный заряд, постоянную Больцмана и фотометрическую константу световой отдачи.
Она присутствует как коэффициент между энергией E и частотой ν фотона в формуле Планка:

Скорость света c связана с частотой ν и длиной волны λ соотношением:

С учётом этого соотношение Планка записывается так:

Теория Бора. Энергетический уровень. Главное квантовое число. Радиус стационарной орбиты для одноэлектронного атома. Энергия электрона на стационарной орбите в одноэлектронном атоме. Волновое число. Уравнение Бальмера-Ридберга. Постоянная Ридберга. Атомный спектр водорода. Несостоятельность теории Бора.
См. билет №6 «Квантовые постулаты Бора»
Энергетический уровень — собственные значения энергии квантовых систем, то есть систем, состоящих из микрочастиц (электронов, протонов и других элементарных частиц) и подчиняющихся законам квантовой механики. Каждый уровень характеризуется определённым состоянием системы, или подмножеством таковых в случае вырождения. Понятие применимо к атомам (электронные уровни), молекулам (различные уровни, соответствующие колебаниям и вращениям), атомным ядрам(внутриядерные энергетические уровни) и т.д.
Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический. Является первым в ряду квантовых чисел, который включает в себя главное, орбитальное и магнитное квантовые числа, а также спин. Эти четыре квантовых числа определяют уникальное состояние электрона в атоме (его волновую функцию). Главное квантовое число обозначается как  . При увеличении главного квантового числа возрастают радиус орбиты и энергия электрона. Главное квантовое число равно номеру периода элемента.
. При увеличении главного квантового числа возрастают радиус орбиты и энергия электрона. Главное квантовое число равно номеру периода элемента.
Наибольшее число электронов на энергетическом уровне с учётом спина электрона определяется по формуле 
Согласно квантохимическим расчетам, радиус мест наибольшей вероятности нахождения электрона в атоме водорода в нормальном состоянии (главное квантовое число n = 1) равен 0,529 Å. Этот радиус является одной из основных атомных констант, он получил название боровский радиус.
Радиус первой орбиты оказывается равным  метра. Эта константа называется боровским радиусом.
метра. Эта константа называется боровским радиусом.
Подставляя это значение в выражение для энергии, получим, что 
Волновое число (по определению это обратная длина волны или число длин волн, укладывающихся на 1 см) фотона, излучаемого атомом водорода за один переход из возбужденного состояния с главным квантовым числом  в состояние с неким фиксированным главным квантовым числом
в состояние с неким фиксированным главным квантовым числом 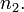

где  постоянная Ридберга (она равна 109 737,31568539 см−1).
постоянная Ридберга (она равна 109 737,31568539 см−1).
Линии спектра серии Лаймана обусловлены переходом электронов на нижний уровень с квантовым числом n = 1 с уровней с квантовыми числами n = 2, 3, 4, 5, 6…Линии Лаймана лежат в ультрафиолетовой области спектра. Линии спектра серии Бальмера обусловлены переходом электронов на уровень с квантовым числом n = 2 с уровней с квантовыми числами n = 3, 4, 5, 6… и лежат в видимой области спектра.
Линии спектра серий Пашена, Брэкета и Пфунда обусловлены переходом электронов на уровни с квантовыми числами n, равными 3, 4 и 5 (соответственно), и расположены в инфракрасной области спектра.
 2018-01-21
2018-01-21 1322
1322
