Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При растворении твердого тела в воде растворение прекращается, когда получается насыщенный раствор, т. е. когда между растворяемым веществом и находящимися в растворе молекулами того же вещества установится равновесие. При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солыо и перешедшими в раствор нонами. Например, в насыщенном растворе сульфата кальция устанавливается равновесие
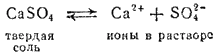
Константа равновесия для этого процесса выразится уравнением: 
Знаменатель дроби — концентрация твердой солн — представляет собою постоянную величину, которую можно ввести в константу. Тогда, обозначая  , получим:
, получим:
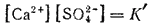
Таким образом, в насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться; ее называют произведением растворимости электролита и обозначают буквами ПР.
Заменив величину на, получим:

Ио́нное произведе́ние воды́ — произведение концентраций ионов водорода Н+ и ионов гидроксила OH− в воде или в водных растворах, константа автопротолиза воды.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:

где:
· [H+] — концентрация ионов гидроксония (протонов);
· [OH−] — концентрация гидроксид-ионов;
· [H2O] — концентрация воды (в молекулярной форме) в воде;
Концентрация воды в воде, учитывая её малую степень диссоциации, величина практически постоянная и составляет (1000 г/л)/(18 г/моль) = 55,56 моль/л.
При 25 °C константа диссоциации воды равна 1,8·10−16моль/л. Уравнение (1) можно переписать как:

Обозначим произведение K·[H2O] = Kв = 1,8·10−16 моль/л·55,56 моль/л = 10−14моль²/л² = [H+]·[OH−] (при 25 °C).
Константа Kв, равная произведению концентраций протонов и гидроксид-ионов, называется ионным произведением воды. Она является постоянной не только для чистой воды, но также и для разбавленных водных растворов веществ. C повышением температуры диссоциация воды увеличивается, следовательно, растёт и Kв, при понижении температуры — наоборот.
Водоро́дный показа́тель, pH — мера активности (в очень разбавленных растворах она эквивалентнаконцентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифмактивности водородных ионов, выраженной в молях на один литр:

 2018-01-21
2018-01-21 719
719








