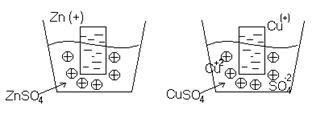
Количество ионов, которые будут взаимодействовать с раствором соли, будет меньше, т.к. соль уже содержит некоторое количество ионов этого металла.
Т.е. имеет большое значение какой металл и какая концентрация металла в соли, поведение металла.
Например: медь из раствора соли перейдет в электрод, т.е. имеются в виду положительные ионы.
Гальванический элемент – любое устройство, позволяющее получать электрический ток, за счет протекания химических реакций.
Гальваническая цепь – последовательная совокупность скачков потенциала на границе раздела фаз.
Максимальная разность потенциалов, отвечающая обратимому протеканию химической реакции – ЭДС (Е)
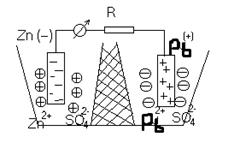 |
Каждые два металла, будучи погруженными в растворы их солей, которые сообщаются между собой посредством сифона, заполненного электролитом, образуют гальванический элемент. Пластинки металлов, погруженные в растворы, называются электродами элемента.
Если соединить наружные концы электродов (полюсы элемента) проволокой, то от металла, у которого величина потенциала меньше, начинают перемещаться электроны к металлу, у которого она больше (например, от Zn к Pb). Уход электронов нарушает равновесие, существующее между металлом и его ионами в растворе, и вызывает переход в раствор нового количества ионов – металл постепенно растворяется. В то же время электроны, переходящие к другому металлу, разряжают у его поверхности находящиеся в растворе ионы - металл выделяется из раствора.
Электрод, на котором протекает окисление, называется анодом. Электрод, на кото ром протекает восстановление, называется катодом.
В свинцово-цинковом элементе цинковый электрод является анодом, а свинцовый – катодом.
Таким образом, в замкнутом гальваническом элементе происходит взаимодействие между металлом и раствором соли другого металла, не соприкасающимися непосредственно друг с другом. Атомы первого металла, отдавая электроны, превращаются в ионы, а ионы второго металла, присоединяя электроны, превращаются в атомы. Первый металл вытесняет второй из раствора его соли. Например, при работе гальванического элемента, составленного из цинка и свинца, погруженных соответственно в растворы Zn(NO3)2 и Pb(NO3)2 у электродов происходят следующие процессы:
Zn – 2ē ® Zn2+
Pb2+ + 2ē ® Pb
Суммируя оба процесса, получаем уравнение Zn + Pb2+ ↔ Pb + Zn2+, выражающее происходящую в элементе реакцию в ионной форме. Молекулярное уравнение той же реакции будет иметь вид:
Zn + Pb(NO3)2 ↔ Pb + Zn(NO3)2
Электродвижущая сила гальванического элемента равна разности потенциалов двух его электродов. При определении его всегда вычитают из большего потенциала меньший. Например, электродвижущая сила (Э.д.с.) рассмотренного элемента равна:
| Э.д.с. = | -0,13 | – | (-0,76) | = 0,63 v |
| EPb | EZn |
Такую величину она будет иметь при условии, что металлы погружены в растворы, в которых концентрация ионов равна 1 г-ион/л. При других концентрациях растворов величины электродных потенциалов будут несколько иные. Их можно вычислить по формуле:
E = E0 + (0,058 / n) • lgC уравнение Нернста
или E = E0 + 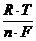 • lgC
• lgC
где E - искомый потенциал металла (в вольтах)
E0 - его нормальный потенциал
n - валентность металла (зарядность иона)
С - концентрация ионов в растворе (г-ион/л)
F – число Фарадея
R – универсальная газовая постоянная
Т – температура по абсолютной шкале
Пример:
Найти электродвижущую силу элемента (э. д. с.) образованного цинковым электродом, опущенным в 0,1 М раствор Zn(NO3)2 и свинцовым электродом, опущенным в 2 М раствор Pb(NO3)2.
Решение:
Вычисляем потенциал цинкового электрода:
EZn = -0,76 + (0,058 / 2) lg 0,1 = -0,76 + 0,029 • (-1) = -0,79 v
Вычисляем потенциал свинцового электрода:
EPb = -0,13 + (0,058 / 2) lg 2 = -0,13 + 0,029 • 0,3010 = -0,12 v
Находим электродвижущую силу элемента:
Э. д. с. = -0,12 – (-0,79) = 0,67 v
Электролиз
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
Сущность электролиза заключается в том, что при пропускании тока через раствор электролита (или расплавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные – к аноду. Достигнув электродов, ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита или водород и кислород из воды.
Для перевода различных ионов в нейтральные атомы или группы атомов требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений.
На катоде источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”. На аноде происходит отдача электронов анионами, поэтому анод является “окислителем”.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов,
на катоде — восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются:
на аноде — окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
на катоде — восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. При использовании инертных электродов используют следующие правила:
1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих в своем составе анионы F-, SO42- , NО3-, РО43- (если электролизу подвергается соль кислородсодержащей кислоты или сама кислота, то разряжаются гидроксильные ионы, а не ионы кислородных остатков), а также растворов щелочей выделяется кислород Образующиеся при разряде гидроксильных ионов нейтральные группы ОН- тотчас же разлагаются по уравнению:
4OH- ® 2H2O + O2 В результате у анода выделяется кислород.
б) при окислении анионов Сl-, Вr-, I- выделяются соответственно хлор, бром, иод;
в) при окислении анионов органических кислот происходит процесс:
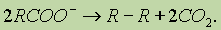
2. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl3+, на катоде выделяется водород; если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл. Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его ионы (легче всего разряжаются ионы Аu3+, Ag+; труднее всего Li+, Rb+, K+).
Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого отрицательный потенциал меньше (или положительный – больше). Например, из раствора, содержащего ионы Zn2+ и Cu2+, сперва выделяется металлическая медь. Но величина потенциала металла зависит также и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала).
3. При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al+ и Н+, на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода. Только при электролизе солей натрия, кальция и других металлов до алюминия включительно разряжаются ионы водорода и выделяется водород.
Рассмотрим в качестве примера электролиз водного раствора хлорида меди на инертных электродах. В растворе находятся ионы Сu2+ и 2Сl-, которые под действием электрического тока направляются к соответствующим электродам:
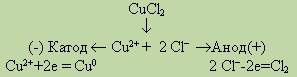
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl- и выделения хлора протекает окисление анода (меди). В этом случае происходит растворение самого анода, и в виде ионов Си он переходит в раствор. Электролиз CuCl2 с растворимым анодом можно записать так:
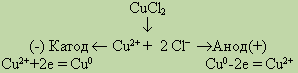
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Электролиз раствора хлорида никеля NiCl2
Раствор содержит ионы Ni2+ и Cl-, а также в ничтожной концентрации ионы Н+ и ОН-. При пропускании тока ионы Ni2+ перемещаются к катоду, а ионы Cl- – к аноду. Принимая от катода по два электрона, ионы Ni2+ превращаются в нейтральные атомы, выделяющиеся из раствора. Катод постепенно покрывается никелем.
Ионы хлора,достигая анода, отдают ему электроны и превращаются в атомы хлора, которые, соединяясь попарно, образуют молекулы хлора. У анода выделяется хлор.
Таким образом, у катода происходит процесс восстановления, у анода – процесс окисления.
 2018-01-21
2018-01-21 3427
3427
