Предисловие.
Будучи огорчен качеством преподавания химии в РНИИМУ, и тем более, способом последующего контроля качества образования – тестами, я решил оказать посильную помощь студентам в сдаче оных. Пособие представляет собой краткую, насколько возможно, инструкцию, как минимально загрузив голову таки сдать этот окаянный тест. Я исследовал большое их количество, обобщил результаты.
На каждый вид вопросов я постарался дать ответ, в меру научный, чтобы все-таки не слишком уйти от своих химических корней, но и достаточно ясный, чтобы он мог быть воспринят среднестатистическим студентом. Теперь я представляю свой труд для использования широкой общественностью, надеюсь, моё творение сможет послужить к чьей-нибудь пользе.
Мы несколько озадачены выбором материала. В родном для авторов этого труда вузе Химическое равновесие и Химическая кинетика — две отдельных темы, по которым сдаётся два отдельных коллоквиума. Да и в РНИМУ в недавнем прошлом это были две разные темы (их и раньше мало кто понимал). Объединение их в одну еще более снизит понятность. Впрочем, сдавать тест всё равно надо.
Конечно, многим хотелось бы иметь готовые ответы и не париться. Думаю, что за годы работы eois общественность накопила некоторый объем ответов, он постепенно совершенствуется, доля верных ответов растет, уже в 2016 она была больше 70%. Правда, обновление вопросов в 2017 добавило веселья. Однако, в отношении химии мне это кажется неудачным путем. Объясню, почему я так считаю. Во-первых, вопросов большое количество, и они, как назло, очень похожи. Это делает трудным списывание с правильных ответов, и, одновременно, делает тесты уязвимыми к методичкам вот такого плана, с разбором вопросов на группы и злой иронией по этому поводу. Во-вторых, некоторые персонажи, как Карина, например, почему-то борются со списыванием, что делает этот процесс не самым простым трюком. А глядя на всё это глобально, по-моему, все же лучше что-то понимать и мыслить, чем списывать.
Заранее благодарен за адекватные комментарии, дополнения и исправления к тексту. Текст создан исключительно из гуманных соображений и распространяется безвозмездно.
Удачи, ни пуха, ни пера, дорогие любители химии.
Алексей «Леша-химик» Федоров,
24.09.2017.
Тема 4. Химическое равновесие. Кинетика.
Введение: Честно говоря, глядя на этот странный гибрид ежа с ужом, то есть равновесия и кинетики, мы как то тихо, медленно и печально охуеваем. Даже не знаю, что сказать. Приведём все возможные формулы, с комментариями, где что, но учтите, пользоваться ими надо с большой-пребольшой осторожностью.
1) Формула, как рассчитать скорость реакции:
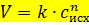
Тут V — скорость реакции, (моль/л*время), k — константа скорости (размерность может быть разной), cисх — концентрация исходного вещества (моль/л), n — называется порядок по веществу, короче, степень. Концентраций может быть несколько, тогда они перемножены, каждая в своей степнени.
2) Формула, как связать константу скорости и период полураспада (реакции первого порядка).
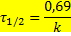
 — период полураспада (время), k — константа скорости. Не нужно.
— период полураспада (время), k — константа скорости. Не нужно.

Кс — константа химического равновесия, […] — концентраци того, что указано, если веществ несколько, то они перемножены, коэффициенты как степени. Формула подстраивается под реакцию, например,
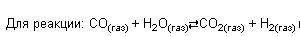

Стоит учитывать, что если в реакцию входят твердые вещества, то их концентрации не учитываются в константе (потому что у твердых веществ нет концентрации). И так далее. ООООчень важная формула, постарайтесь запомнить.
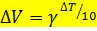
Формула не совсем как в учебнике, но для удобства решения задач она слегка преобразована. ΔТ — изменение температуры, γ — температурный коэффициент Вант-Гоффа, 10=10, а ΔV — величина, показывающая, во сколько раз изменится скорость реакции, если изменить температуру.
5) Их еще много, но, поскольку мы не уверены, что они понадобятся, не приводим.
Типичные вопросы:
1. Что от чего зависит.
Пример:

…
Как с этим бороться:
Довольно несложно. Есть следующие варианты:
· Скорость гомогенной реакции — природа и концентрация исходных веществ (не продуктов), температура, давление (если реагируют газы), наличие катализатора или ингибитора.
· Скорость гетерогенной реакции — то же самое + площадь межфазной поверхности
· Константа скорости — природа реагирующих веществ, температура, катализатор-ингибитор.
· Энергия активации — природа реагирующих веществ, катализатор-ингибитор.
2. Концентрация и сдвиг равновесия.
Пример:

…
Как с этим бороться:
Заурядно. Зависимость такая:
При увеличении концентрации исходного равновесие смещается вправо.
При увеличении концентрации продукта равновесие смещается влево.
Короче говоря, в виде значков
↑исх => равновесие→
↑прод => равновесие ←
Еще короче, равновесие смещается в сторону от той части, в которой увеличивают концентрацию, или равновесие смещается в ту сторону, где уменьшают концентрацию.
При уменьшении концентраций эффект очевидно будет обратным. Теперь главное понять, вещество, про которое спрашивают, исходное или продукт? Например, в приведенной задаче хотят, чтобы уменьшение водорода смещало влево. Значит, водород должен быть слева. Или, по-другому, водород должен быть исходным веществом. Подходит только D. Обратите внимание, что закон Маши П. больше не действует, при множественном выборе из 4 не обязательно верно 2.
3. Температура и равновесие.
Пример:

…
Как с этим бороться:
Похоже на предыдущую задачу, но много более занудно. Для краткости приведем таблицу:
| H: | Температура | равновесие | Константа равновесия |
| ΔH>0 Эндотермическая | Повышение ↑ температуры | Вправо → | Увеличится↑ |
| Понижение ↓ температуры | Влево ← | Уменьшится↓ | |
| ΔH<0 Экзотермическая | Повышение ↑ температуры | Влево ← | Уменьшится↓ |
| Понижение ↓ температуры | Вправо → | Увеличится↑ |
Из трех факторов: ΔH, температура и равновесие (или константа) должно быть дано два, третий находится по соответствию. В приведенном примере сказано, что Т↓, и при этом ΔH<0. Находим в таблице такую строку, видим, что константа увеличится. Может быть дано изменение константы и температуры, и запрошено ΔH, делается так же, только в обратном порядке.
4. Факторы и разы.
Пример:

Эх, раз, ещё раз…
Как с этим бороться:
Разберем факторы по отдельности.
1) Концентрации. Там есть формула, см. условия внимательно. В этой формуле есть с(А) и с(В) — концентрации веществ А и В. У них могут быть разные степени, в примере у В — 0,5, а у А не стоит, значит 1. Мысленно подставляем изменение в разах в формулу, если предлагают увеличить В в 9 раз, то подставляем 90,5=3, то есть скорость увеличится в 3 раза. Если концентрацию А изменить в 2 раза, то 21=2 раза, скорость увеличится в 2 раза. Если концентрацию предлагают уменьшать, то и скорость должна уменьшаться. От концентрации С скорость на зависит, ведь С не входит в формулу.
2) Давление. В примере нет, но бывает. Если давление изменить в N раз, то все концентрации меняются в N раз, но только при условии, что все вещества газы, но только при условии, что все вещества газы. Дальнейшие оценки как в концентрациях. Обратите внимание, в примере реакция в растворе. Например, если бы реакция протекала в газе, и при этом давление увеличивалось бы в 3 раза, то с(А) и с(В) увеличились бы в 3 раза, а делее, вставив в формулу эти разы 31·30,5=5,2 раза, ну примерно. А если давление дано, но реакция в растворе, то давление не повлияет. Будьте внимательны.
3) Температура. Для оценки температуры использовать γ, которая в условии тоже есть, и формулу Вант-Гоффа
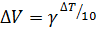
Вставить температуру и эту стремную закорючку из условия, осторожно посчитать на калькуляторе, или в уме, благо несложно. В примере это будет:
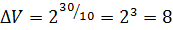 раз.
раз.
А ваще, можно и исключением было эти 8 раз найти. Обратите внимание, что между температурой и скоростью прямая зависимость, при увеличении температуры скорость увеличивается, при уменьшении уменьшается.
5. Критерий равновесия.
Пример:

…
Как с этим бороться:
Критерий равновесия это ΔG=0 или ΔH=TΔS, как тут.
6. Период полураспада.
Пример:

Тоже классика…
Как с этим бороться:
Для задач с периодом полураспада удобно использовать таблицу вида:
| Время | % осталось | % потрачено (прореагировало, распалось, вывелось, спиздили или потеряли иным способом) |
| 0 (ноль, реакция еще не началась) | 100% | 0% |
| 1 период полураспада | 50% | 50% |
| 2 периода полураспада | 25% | 75% |
| 3 периода полураспада | 12,5% | 87,5% |
Суть такова: каждый перод полураспада количество вещества уменьшается в 2 раза по сравнению с исходным (полураспад же). Было 100%, уменьшилось наполовину, стало 50%. Было 50%, уменьшилось наполовину, стало 25%. И так далее. Теоретически, процесс бесконечен, но практически в тестах дальше трех периодов не уходят. В скрине надо, чтобы прореагировало 75%, при этом период равен 20 минут. Из таблицы видно, что нужно 2 периода, то есть 40 минут. Не перепутайте, когда нужно ответить, сколько осталось, а когда — сколько потрачено.
7. Константа равновесия и энергия Гиббса.
Пример:

.
Как с этим бороться:
Возможно три случая:
1) Кс=1, тогда ΔG=0 или ΔH=TΔS, состояние равновесия, см. позапрошлый вопрос.
2) Кс>1, тогда ΔG<0 или ΔH<TΔS, идёт прямая реакция.
3) Кс<1, тогда ΔG>0 или ΔH>TΔS, идёт обратная реакция.
8. Последовательные, параллельные процессы и энергия активации.
Пример:

…
Как с этим бороться:
При внешнем сходстве, возможно две принципиально разных ситуации.
1) Параллельные реакции, А=В, А=С. Тогда может быть два варианта:
1.1. Еа1>Ea2, тогда в большем количестве образуется продукт С
1.2. Еа1<Ea2, тогда в большем количестве образуется продукт В
Короче, больше образуется продукта в реакции с меньшей энергией активации.
2) Последовательные реакции, А=В, В=С. Тогда тоже два варианта.
2.1. Еа1>Ea2, тогда самая медленная, лимитирующая стадия первая, накапливается продукт С
2.2. Еа1<Ea2, тогда самая медленная, лимитирующая стадия вторая, накапливается продукт В
Короче, самая медленная, лимитирующая — стадия с большей энергией активации Еа. Это, кстати, был такой отдельный вопрос.
9. Задачи про скорость, температуру и температурный коэффициент Вант-Гоффа..
Пример:

Легкий пример…
Как с этим бороться:
Да несложно, в общем то. Брать формулу Вант-Гоффа, аккуратно подставлять числа и аккуратно же считать.
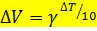 — вам в помощь.
— вам в помощь.
Напомним, что ΔV — во сколько раз изменится скорость, ϒ — температурный коэффициент, ΔТ — изменение температуры, 10 – просто 10. Иногда просят выразить ϒ, это делается так:
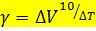
В примере как раз об этом. 
10. Задача про направление процесса.
Пример:
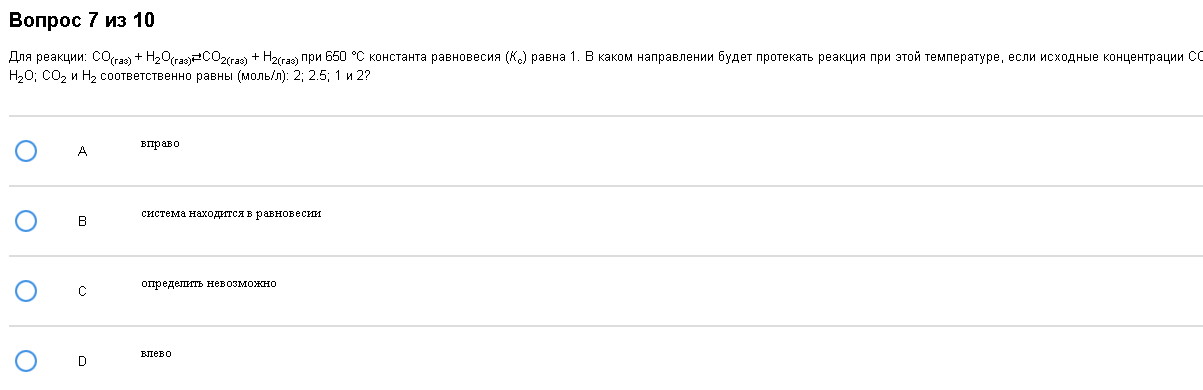
Расчеты-расчётики…
Как с этим бороться:
Для этого нужно посчитать величину Пс. Эта самая Пс считается точно так же, как Кс, однако есть нюанс. Там концентрации равновесные (конечные), а тут текущие (исходные). Если нюанс непонятен, унывать не надо. Просто брать что дано и считать. Просто считаем Пс:
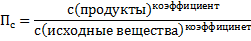
Рассчитанную величину сравнивают с данной Кс.
Если Пс > Kc, реакция идёт влево
Пс < Kc, реакция идёт вправо.
Пс = Kc, реакция не идёт, состояние равновесия.
В скрине:
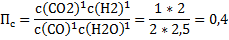
Рассчитанное сравниваем:
Пс=0,4 (расчет) < Кс=1 (дано), реакция идёт вправо. Считайте внимательно.
11. Задача про рассчитайте скорость/константу скорости/концентрацию от скорости.
Пример:

Нелегкий пример…
Как с этим бороться:
В общем случае нетрудно, но, как правило, задача осложнена побочными обстоятельствами. Если математика или школьная программа — это не ваше, пожалуйста, лучше пройти мимо.
Для расчетов используется формула

Где, напомним, V — скорость реакции, k — костанта скорости, c — концентрация исходного, n — порядок (степень) при концентрации. За размерности не беспокойтесь, они сложные, но вы можете с чистой совестью забить. Внимательно читайте условия, некоторые слова могут быть важны. n, которая порядок реакции, обычно пишется текстом как «реакция второго/первого/нулевого порядка». Если исходных веществ два, то:

И вроде бы всё ничего, подставляй и считай, но есть сложности.
1) Числа. В дано странные числа, вида 3*10-3 и тому подобное говно. Можно или преобразовать их 3*10-3 =0,003, то есть степень десятки — это количество знаков от запятой до числа, считая число, от запятой до тройки три знака, включая тройку. Но проще не насиловать мозг, а свалить всё в калькулятор, благо, 21 век на дворе и калькулятор есть в любой приличной мобиле. Переключаем в инженерный вид (на яблофонах это вроде бы делается поворотом набок, на ведре по кнопке), и пожалуйста, с помощью кнопки «ХУ» или «^» можете вводить, что душе угодно. Заренее разберитесь, как это делается на вашей мобиле. Например, 3*10-3 = 3 * 10 ХУ -3. Дальше калькулятор сам разберется, слава роботам!
2) В некоторых задачах в условии написано «смешали два равных объема рствора». Внимание! Такая запись означает, что нужно разделить обе концентрации из условия на 2! Связано с тем, что растворы разбавляют друг друга. Считать по данным концентрациям не стоит, неправильно получится.
3) Выражение букв из формулы. Это видно в примере. Если просят выразить константу, то:
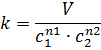
Если хотят концентрацию, то это еще сложнее
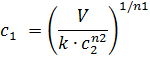
Случай, когда концентрация одна, мы не рассматриваем. Если Вам в приведенной выше записи нихера не понятно, то это вас не спасет, а если понятно, то сами догадаетсь.
В примере V=4.5*10-4, k=3*10-3, c(Н2)=0.5, n(Н2)=1, n(Br2)=0.5, c(Br2)-просят найти. Берем формулу с выраженной концентрацией, вставляем:
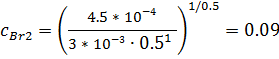
Расчеты, как видите, непростые. Делать всё на калькуляторе, аккуратно, калькулятор умеет скобки, степени, всё что угодно, перепроверять расчёты по сто раз!
4) В некоторых задачах хотят концентрацию не вот щас, а «когда прореагирует N моль вещества Х». Общая рекомендация такая. Если, например, было А=0,4 моль, В=0,2 моль, прореагировало 2А+В, и нужно определить скорость, когда прореагировало 0,2 моль А, то учтем, что к этому моменту прореагирует 0,1 моль В (они реагируют в соотношении 2:1). Значит, с(А) = 0,4—0,2=0,2 моль, а с(В)=0,2—0,1=0,1 моль (это минусы), исходя из этих пересчитанных концентраций считаем скорость.
12. Задача про хер знает что.
Пример: 

Жопа…
Как с этим бороться:
Не даём общих рекомендаций, так как задачи довольно разнообразны. Если математика и логика — это не ваше, стоит пройти мимо. Просто разберем примеры.
1) Просто взять выражение Кс, подставить всё, что дано, и расчитать Кс. Напомним, что Кс:

Тут:
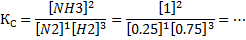
Расчеты оставим для самостоятельной работы
2) Намного более сложная задача. Доступна только рассуждениям. Если прореагировало 60% SO2, это значит, прореагировало 60% от 3 моль, то есть 1,8 моль. Тогда осталось 1,2 моль. SO3 находится в соотношении 1:1 с SO2 (по реакции, из коэфициентов), значит, его образовалось тоже 1,8 моль. О2 с SO2 находится в соотношении 1:2, то есть его расходуется 0,9 моль (1,8/2). Исходные, SO2 и О2, расходуются, SO3 образуется. Остается SO2 — 1.2 моль, О2— 1,1 моль, SO3 — 1,8 моль. Подставляем найденные концентрации в выражение константы равновесия Кс (не приводим, догадайтесь сами). У нас получилось примерно 2,045, округлили до 2. Решение удобно представить таблицей:
| SO2 | O2 | SO3 | |
| Было | 3 моль дано | 2 моль дано | 0 моль дано |
| Прореагировало | -1,8 моль Нашли как 60% от 3 моль. Минус, потому что в реакции расходуется | -0,9 моль Нашли как 1,8/2, потому что О2 и SO2 реагируют в пропорции 1:2. Минус, потому что расходуется. | +1,8 моль Нашли, так как SO3 и SO2 по реакции в пропорции 1:1. Плюс, потому что в реакции образовалось. |
| Осталось | 1,2 моль Нашли как 3-1,8 моль | 1,1 моль Нашли как 2-0,9 | 1,8 моль Нашли как 0+1,8 моль |
Подобное сведение в таблицу часто (но не всегда) помогает упорядочить решение, поэтому рекомендовано.
Еще примеры без решений:

Подсказка: свести к таблице вида «было-прореагировало-осталось», найти, сколько прореагировало NO, NO2 найти по их соотношению через реакцию.
13. Константа равновесия и разные выражения.
Пример:

…
Как с этим бороться:
Написать выражение константы равновесия, подставить числа и концентрации, возможно, преобразовать. Учесть, что концентрации твердых веществ не вставляются. В примере ответ будет D.
14. Разное.
Пример:

…
Как с этим бороться:
Почитать САРС-овскую методичку, там есть небольшой кусочек теории, должно хватить. Тут ответ А.
Мы проверяем наши теоретические выкладки на практике, прежде чем предложить вам. Как видите, всё не так сложно.
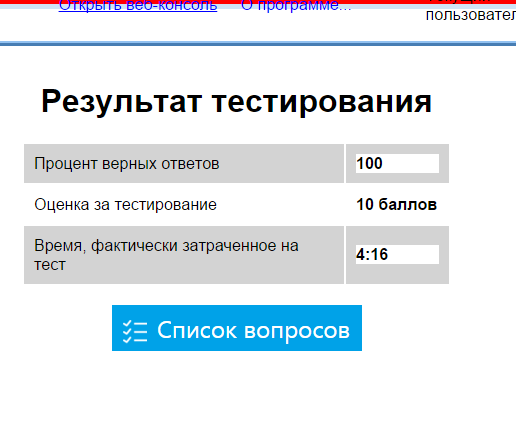
Спасибо за внимание
DONAT PLEASE! 
Если Вам понравилось, Вы можете поддержать нас тут
https://vk.com/mars_him_prom
через функцию «поддержать…»
 2017-11-01
2017-11-01 1738
1738