В 1889 г. шведский ученый Сванте Аррениус на основании экспериментов вывел уравнение, которое названо его именем 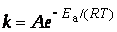 ,
,
где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального 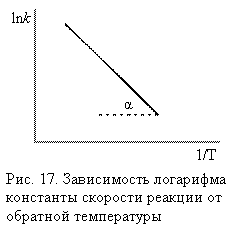 логарифма; Е а – постоянная, называемая энергией активации, определяемая природой реакции. Значения Е а для химических реакций лежат в пределах 40 – 400 кДж/ моль.
логарифма; Е а – постоянная, называемая энергией активации, определяемая природой реакции. Значения Е а для химических реакций лежат в пределах 40 – 400 кДж/ моль.
После логарифмирования уравнение имеет вид
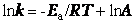
Если представить графическую зависимость ln k = f (1/ T), то она имеет вид (рис 17).
Здесь tgα = - Е а/ R и Е а = - R tgα. Отрезок, отсекаемый на оси ординат равен ln А.
Итак, константа скорости реакции (и скорость) возрастает с увеличением температуры по экспоненциальному закону. В соответствии с уравнением Аррениуса константа скорости реакции уменьшается с ростом энергии активации. Уравнение Аррениуса позволяет рассчитывать константы скорости (и скорости) при различных температурах.
 2015-01-30
2015-01-30 2172
2172








