Равновесная концентрация - концентрация данного вещества, которое оказалось в системе при достижении ею химического равновесия.
(можете дальше не читать, просто вспомните какую-нибудь задачу из контрольной и напишите её, Хохрякову плевать на слова - главное знать как решать - АВ)
1. Пишут уравнение реакции.
2. Пишут под формулами уравнения нач. концентрации исходных веществ (в моль/л). Если их нет в условии, они обычно принимаются равными нулю.
3. Принимают, что в ходе реакции до состояния равновесия прореагировало x моль/л какого-либо вещества. Обычно за x принимают изменение концентрации того реагента, стехиометрический коэффициент при котором в уравнении реакции наименьший, чтобы избежать дробных коэффициентов при неизвестном x. Например, прореагировало x моль/л вещества А.
4. По уравнению реакции определяют изменение концентраций других веществ.
5. Определяют равновесные концентрации веществ. При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций исходных веществ и увеличение концентраций продуктов реакции.
А + b В = c С + D
Было [А]0 [В]0 [С]0 0
число молей
по уравнению 1 b c 1
изменение конц-ий x b x c x x
Стало [А]0 - x [В]0 – bx [С]0 + c x x
6. Пишут выражение закона действующих масс. Подставляют в него найденные значения равновесных концентраций. Kр=[C]c * [D] / [A]*[B]b, Kр=([C]0+cx)c *(x)/([A]0-x)*([B]0-bx)b
7. Решают уравнение. При этом учитывают, что отрицательный корень не имеет физического смысла, и убыль концентрации исходного вещества не может быть больше величины самой концентрации (начальная концентрация исходного вещества не может быть меньше его остаточной равновесной концентрации).
8. Находят равновесные концентрации. [А] = [А]0- x; [B] = [B]0 - b x; [C] = [С]0 + cx; [D] = x.
61.Галогены. Получение. Как изменяется энергия связи и её длина в молекулах галоге-
нов? Напишите уравнения реакций галогенов с водой; растворами щелочей на холоду
и при нагревании.
F2, Cl2,Br2,I2
s2p5 у них не хватает только одного электрона до заполнения электронной оболочки, из-за чего они крайне электроотрицательны. Их Э.О. зависит от радиуса атома (чем меньше, тем электроотрицательнее)
Степени окисления: -1, 0, +1, +3, +5, +7 (кроме фтора, у него только -1 и 0)
Получение:
KF→tэл-лиз F2 – электролиз расплава (в конспекте «написано фиг получишь», думаю не просто так:). Хранить только в фторопластовой посуде или в никелевой
Cl2 – эл-лиз водного раствора (дёшево)
Br получают из побочных примесей нефти
Br- + Cl2→Br2
I –из морских водорослей (сравнительно дорого)
I- + Cl2→I2
Как изменяется энергия связи и её длина в молекулах галогенов:
Энергия связи от фтора к хлору сначала увеличивается на 88 кДж, а после уменьшается вследствие увеличения длины связи (по энергии).
Относительно малая прочность фтора объясняется тем, что связь F-F образована только непарными p-электронами, когда у других связь образовано по дативному механизму вследствие взаимного использования неподеленными парами p-электронов одного атома вакантных d-орбиталей другого.
Также можно добавить, что HF – диполь как вода и может образовывать комплекс: Fe3++F-→[: FeF6]3-
С водой:
Все кроме фтора (A – галоген)
Cl2 +H2O→ Cl *H2O + HCl +HOCl – у хлора 50% (хлорная вода), у брома меньше, у йода ничтожно
I2 + H2O +KI → KI3, KI5, KI7, KI9 – полииодиды
F2+ H2O → HF + O(в уч. нет, но в к. есть) +O2 + O3 + OF2 + H2O2
С щёлочью:
У фтора F2 + OH-→ F-+OF2 + H2O
У остальных:
Cl 2+ OH-→ Cl -+ ClO-+ H2O
Cl2 + OH-→t Cl -+ ClO3-+ H2O вследствие диссоциации ClO-
62. Водород. Получение в промышленных и лабораторных условиях. Химические свойст-
ва. Степени окисления. Простые и комплексные гидриды.
Водород – 1-й элемент Периодической таблицы (заряд ядра 1), химический знак – Н, относительная атомная масса (атомный вес) 1,008 (округленно 1). Валентность водорода в соединениях равна единице, наиболее распространенная степень окисления +1. Молекула водорода Н2, молекулярная масса (молекулярный вес) 2,016 (округленно 2 а.е.м). Молярная масса 2 г/моль.
Водород – газ, типичный неметалл. Образует прочные ковалентные двухатомные молекулы Н2.
Водород становится жидким при очень низких температурах (-253 °С), а твердый водород получить еще труднее (температура плавления твердого водорода -259 °С).
Известны 3 изотопа водорода: 11H (или просто H), 21H (или D), 31H (или T).
Получение:
В промышленности большое количество водорода получают именно из метана, добавляя к нему при высокой температуре перегретый водяной пар: CH4 + 2 H2O = 4 H2 + CO2
Наиболее чистый водород в промышленности получают электролизом воды:

Реакцию между цинком и водным раствором хлористого водорода (соляной кислотой) наиболее часто используют для получения водорода в лаборатории.
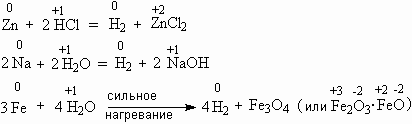

Примеры соединений водорода с типичными s- и р-элементами
В своих соединениях водород находится в одном из трех состояний: гидратированного катиона H+ в растворах, аниона H- в кристаллах ионных гидридов или ковалентно-связанного атома, причем в соответствии со своей ЭО, водород может быть как в степени окисления +1, так и -1.
С неметаллами, имеющими большие ЭО, водород образует соединения с полярными связями – H2O, HF, H2S. Эти, как правило, газообразные соединения обладают кислотными свойствами и при растворении в воде диссоциируют на ионы Н+ и соответствующие анионы.
Взаимодействие с галогенами. При обычной температуре водород реагирует лишь со фтором:
H2 + F2 = 2HF.
С хлором реагирует только на свету, образуя хлороводород, с бромом реакция протекает менее энергично, с йодом не идет до конца даже при высоких температурах.
Взаимодействие с кислородом. При нормальных условиях водород не реагирует с кислородом, при 400 °С реагирует с кислородом, а при 600 °С – с воздухом, при поджигании реакция протекает со взрывом:
2H2 + O2 = 2H2O.
Водород горит в кислороде с выделением большого количества тепла. Температура водородно-кислородного пламени 2800 °С.
Взаимодействие с серой. При пропускании водорода через расплавленную серу образуется сероводород:
H2 + S = H2S.
Взаимодействие с азотом. При нагревании водород обратимо реагирует с азотом, причем при высоком давлении и в присутствии катализатора:
3H2 + N2 = 2NH3.
Взаимодействие с оксидом азота (II). Важное значение имеет взаимодействие водорода с оксидом азота (II), используемое в очистительных системах при производстве азотной кислоты:
2NO + 2H2 = N2 + 2H2O.
Взаимодействие с оксидами металлов. Водород – хороший восстановитель, он восстанавливает многие металлы из их оксидов:
CuO + H2 = Cu + H2O.
Сильным восстановителем является атомарный водород. Он образуется из молекулярного в электрическом разряде в условиях низкого давления. Высокой восстановительной активностью обладает водород в момент выделения, образующийся при восстановлении металла кислотой.
Взаимодействие с активными металлами. Водород является окислителем, присоединяет электрон и превращается в гидрид-ион, который заряжен отрицательно.
При высокой температуре водород соединяется с щелочными и щелочно-земельными металлам и образуя белые кристаллические вещества – гидриды металлов:
2Na + H2 = 2NaH;
Ca + H2 = CaH2.
Применение: Водород используется в качестве горючего в современной ракетной технике. Российская ракета-носитель "Энергия" выводила на орбиту более 100 тонн различных грузов благодаря водородно-кислородным двигателям. В ее двигателях использовались жидкий кислород и жидкий водород.
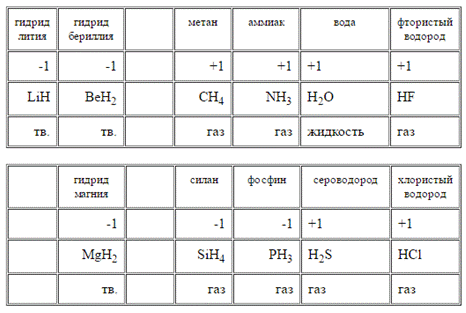
Ионные гидриды – это соединения щелочных и щелочноземельных металлов с водородом, где водород проявляет степень окисления -1. Бесцветные кристаллические вещества высокой реакционной способности.
Получение
1. Взаимодействие металла с водородом
Ca + H2 = CaH2
2. Взаимодействие натрия с гидроксидом натрия
2Na + NaOH=Na2O + NaH
1. Взаимодействие с водой
NaH + H2O = NaOH + H2
2. Взаимодействие с кислородом
CaH2 + O2 = CaO + H2O
3. Взаимодействие с кислотой
CaH2 + 2HCl = CaCl2 + 2H2
4. Разложение при нагревании в вакууме
2NaH = 2Na + H2
Ковалентные гидриды – гидриды р-элементов, где водород имеет степень окисления -1. Например, SiH4–силан, AsH3 – арсин, PH3 – фосфин.
Получение
Ковалентные гидриды не получают прямым взаимодействием неметалла с водородом.
Mg2Si + 4HCl = 2MgCl2 + SiH4
1. Взаимодействие с кислородом
SiH4 + 2O2 = SiO2 + 2H2O
PH3 + 2O2 = H3PO4
2. Термическое разложение
SiH4 = Si + 2H2
3. Взаимодействие с водой (в слабощелочной среде)
SiH4 + 4H2O = H4SiO4 + 4H2
Реакция не характерна для арсина и фосфина.
4. С водным раствором щелочи
SiH4 + 2NaOH + H2O = Na2SiO4 + 4H2
Формально к соединениям водорода со степенью окисления -1 относятся и комплексные гидриды, например боро- и алюмогидриды лития Li[BH4] и Li[AlH4] (тетрагидроборат и тетрагидроалюминат лития). Способность образовывать комплексные анионы характерна для координационно-ненасыщенных простых гидридов B, Al и других sp-металлов III группы периодической системы. Комплексные гидриды термодинамически более стабильны по сравнению с простыми гидридами. Боро- и алюмогидриды щелочных и щелочноземельных металлов плавятся без заметного разложения, хорошо растворяются во многих органических растворителях. В воде они разлагаются с выделением водорода:
Li[AlH4] + 6H2O = Li[Al(OH)4·2H2O] + 4H2↑
Комплексные гидриды активных металлов можно получить:
1. Взаимодействием простых гидридов. При этом отчетливо проявляется различие между основными и кислотными гидридами, например:
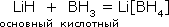
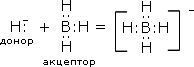
Понятно, что эта реакция может протекать лишь в неводных средах, например в эфире.
2. Прямым синтезом из простых веществ при повышенных температурах и давлении водорода:
Li + Al + 2H2 = Li[AlH4]
3. Взаимодействием простых гидридов с галогенидами:
4LiH + AlCl3 = Li[AlH4] + 3LiCl
4. Комплексные гидриды других металлов получают обменным разложением их галогенидов с боро- и алюмогидридами щелочных металлов:
Li[AlH4] + ScCl3 = Li[ScH4] + AlCl3
Комплексные гидриды, также как и ионные – сильные восстановители.
63. Электролитическая диссоциация в растворах слабых многоосновных кислот. Исполь
зование констант диссоциации для расчёта равновесных концентраций ионов.
64. Характеристика d-элементов I группы Периодической системы: электронная конфигу- рация атомов, степени окисления. Химические свойства металлов, отношение их к
кислотам. Комплексные соединения.
65.Кислородсодержащие кислоты галогенов. Получение. Сопоставление кислотных и
окислительных свойств кислот, а также их солей.
66. Протолитическая теория кислот и оснований Бренстеда–Лоури. Кислоты, основания и
амфолиты.
67.Получение азотной кислоты. Свойства азотной кислоты, окисление металлов и
неметаллов. Строение нитрат-иона. Нитраты металлов и их поведение при нагревании.
1. Способы получения
До начала XX века природная селитра была единственным источником получения азотной кислоты. Этот процесс основан на следующей реакции:
NaNO3 + H2SO4 = HNO3 + NaHSO4
Сейчас различают производство слабой (разбавленной) азотной кислоты и производство концентрированной азотной кислоты.
Процесс производства разбавленной азотной кислоты складывается из трех стадий:
1) конверсии аммиака с целью получения оксида азота
4NH3 + 5О2 → 4NO + 6Н2О
2) окисления оксида азота до диоксида азота
2NO + О2 → 2NO2
3) абсорбции оксидов азота водой
4NO2 + О2 + 2Н2О → 4HNO3
Суммарная реакция образования азотной кислоты выражается
NH3 + 2О2 → HNO3 + Н2О
2) Прямой синтез концентрированной HNО3 основан на взаимодействии жидких оксидов азота с водой и газообразным кислородом под давлением до 5 МПа по уравнению
2N2O4 + O2 + 2H2O → 4HNO3
Свойства:
Как сильная кислота, азотная кислота проявляет общие свойства кислот и взаимодействует с
· оксидами (основными иамфотерными) металлов:
CuO+2HNO3=Cu(NO3)2+H2OCuO+2HNO3=Cu(NO3)2+H2O
ZnO+2HNO3=Zn(NO3)2+H2OZnO+2HNO3=Zn(NO3)2+H2O
· с основаниями (и щелочами, и нерастворимыми):
KOH+HNO3=KNO3+H2OKOH+HNO3=KNO3+H2O
· с солями более слабых кислот:
CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑
Практически установлено, что при действии азотной кислоты на тот или иной металл чаще всего образуется смесь, состоящая из нескольких продуктов восстановления молекул кислоты (Х).
Их количественное соотношение в смеси будет определяться многими факторами, главными из которых являются активность металла, концентрация кислоты и температура реакции.
При составлении уравнений таких реакций указывают, как правило, только один (основной) продукт Х.
Так, при взаимодействии концентрированной HNO3 с малоактивными металлами и металлами средней активности в качестве основного продукта восстановления молекул кислоты выступает азот(IV)-оксид:
Сu + 4HNO3 конц. = Cu(NO3)2 + 2NO2↑ + 2H2O
Zn + 4HNO3 конц. = Zn(NO3)2 + 2NO2↑ + 2H2O
При взаимодействии же с активными металлами основным продуктом может быть N2O:
8Na + 10HNO3 конц. = 8NaNO3 + N2O↑ + 5H2O
Разбавленная азотная кислота, реагируя с малоактивными металлами, восстанавливается обычно до NO:
3Сu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
3Ag + 4HNO3 = 3AgNO3 + NO↑ + 2H2O
а при взаимодействии с активными металлами – до N2 или NH3 (NН4NO3) в зависимости от концентрации кислоты:
5Mg + 12HNO3 разб. = 5Mg(NO3)2 + N2 + 6H2O
4Mg + 10HNO3 (сильно разб.) = 4Mg(NO3)2 + NН4NO3 + 3H2O
Образование NН4NO3 при реакции металла с сильно разбавленной азотной кислотой объясняется взаимодействием выделяющегося аммиака с избытком HNO3 в растворе.
Таким образом, глубина восстановления HNO3 при взаимодействии с металлами возрастает с увеличением активности металла и уменьшением концентрации кислоты в растворе.
Концентрированная азотная кислота (в отличие от разбавленной) при обычных условиях и на холоде не взаимодействует с некоторыми металлами: Al, Fe, Cr, Pb – из-за эффекта «пассивации». Но при нагревании реакция становится возможной.
Железо и хром концентрированной и разбавленной HNO3 при этом окисляются до +3.
Концентрированная и разбавленная HNO3 золото, платину и некоторые другие благородные металлы не растворяет ни при обычных условиях, ни при нагревании. Но смесь, состоящая из трех объемов концентрированной соляной кислоты и одного объема концентрированной HNO3, позволяет это сделать:
Au + HNO3 + 3HCl = AuCl3 + NO↑ + 2H2O
Такая смесь называется иначе «царской водкой» и ее действие объясняется тем, что концентрированная HNO3 обратимо окисляет HCl до хлора, который в начальный момент выделяется в атомарном виде и является активным действующим реагентом. Именно поэтому при растворении благородных металлов в царской водке получаются не их нитраты, а хлориды, т.е. соли соляной кислоты.
Азотная кислота (особенно при нагревании) способна окислять не только металлы, но и многие неметаллы, кроме кремния, фтора, хлора. При этом концентрированная HNO3 восстанавливается чаще всего до NO2, а разбавленная – до NO.
S + 6HNO3 конц. -- H2SO4 + 6NO2↑ + 2H2O
P + 5HNO3 конц. -- H3PO4 + 5NO2↑ + H2O
C + 4HNO3 конц. -- CO2 + 2H2O + 4NO2↑
3P + 5HNO3 разб. + 2H2O = 3H3PO4 + 5NO↑
I2 + 10HNO3 конц. = 2HIO3 + 10NO2↑ + 4H2O
B + 3HNO3 конц. -- H3BO3 + 3NO2↑
Строение нитрат-иона
«Свободный» ион NO3− имеет плоскую структуру с атомами кислорода в углах правильного треугольника (валентные углы равны 120о, длины связей 0,122 нм) и атомом азота в центре:
Разложение нитратов.
1.Нитраты щелочных металлов (кроме нитрата лития)
разлагаются при нагревании на нитрит металла и кислород:
2KNO3 = 2KNO2+O2
2.Нитраты тяжелых металлов (AgNO3 и Hg(NO3)2)
разлагаются до свободного металла, NO2 и кислорода:
Hg(NO3)2 = Hg+2NO2+O2
3. Нитраты остальных металлов (включая нитрат лития)
разлагаются на оксид металла, NO2 и кислород:
2Cu(NO3)2 = 2CuO+4NO2+O2
4.Также выучить: NH4NO3 = N2O+2H2O
NH4NO2 = N2+ 2H2O
68.Платиновые металлы. Степени окисления платиновых металлов. Способы перевода
платиновых металлов в соединения.
Платиновые металлы, платиноиды, химические элементы VIII группы периодической системы Менделеева. К ним принадлежат: рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (легкие Платиновые металлы, плотность ~12 г/см3); осмий (Osmium) Os, иридий (Iridium) Ir, платина (Platinum) Pt (тяжелые Платиновые металлы, плотность ~22 г/см3). Серебристо-белые тугоплавкие металлы; благодаря красивому внешнему виду и высокой химические стойкости Платиновые металлы наряду с Ag и Au называют благородными металлами.
Будучи элементами переходных периодов, платиновые металлы ха-рактеризуются различными степенями окисления. Тенденции к присоединению электронов у них нет, они имеют только металлический характер. Максимально возможные, а также характерные степени окисления возрастают сверху вниз по вертикали (увеличивается расстояние внешних электронных оболочек от ядра) и убывают слева направо по горизонтали (d-орбитали постепенно заполняются электронами).
Осмий и рутений, которые имеют восемь внешних электронов, способны к проявлению максимальных степеней окисления VII и VIII (особенно с кислородом и оксигалогенидами). Степень окисления VI, характерная для рутения, осмия и лишь иногда для платины, иридия и родия, реализуется, главным образом, в кислородных соединениях. Для рутения, осмия, платины и иридия наиболее характерна степень окисления IV, для родия — III, хотя степень окисления III довольно часто встречается в соединениях рутения и иридия. Низшие степени окисления (II, I) у родия, рутения, иридия, осмия встречаются реже. В основном они характерны для их соединений с органическими литандами. Степени окисления I и 0 у всех платиновых металлов реализуются весьма редко, главным образом, в карбонильных соединениях
С повышенной прочностью связей металл - металл в простых веществах связана и их повышенная химическая стойкость. К наиболее химически стойким и трудноокисляемым элементам принадлежат благородные металлы - серебро, золото и шесть платиновых металлов (легкие - рутений, родий, палладий и тяжелые - осмий, иридий, платина). Отсюда возникает проблема переведения в раствор благородных металлов: часть из них может быть растворена в царской водке. Снижение потенциала окисления при действии царской водки (смесь азотной и соляной кислот) достигается за счет образования растворимых комплексов типа [АuС14]- и [PtС16]2-, например:
3Pt + 4NO3 + 18СI- + 16Н+ - 3[РtCl6]2-+ 4NO + 8Н20
В остальных случаях приходится прибегать к щелочной окислительной плавке, например:
Ru + NaClO3 + 2NaOH – Na2Ru04 + NaCl + H20
69. Понятие о химическом равновесии. Принцип Ле Шателье–Брауна.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – состояние химической системы, при котором возможны реакции, идущие с равными скоростями в противоположных направлениях. При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Принцип Ле-Шателье: Если на равновесную систему воздействовать извне, изменяя какой-нибудь из факторов, определяющих положение равновесия, то в системе усилится то направление процесса, которое ослабляет это воздействие.
70. Вода. Строение молекулы. Водородная связь. Явление ассоциации. Электролитическая и термическая диссоциация воды. Химические свойства воды. Аквокомплексы металлов.
Молекула воды состоит из одного атома кислорода, связанного ковалентной связью с двумя атомами водорода H2O (формула воды).
Ассиметричное расположение атомов молекулы воды обусловливает неравномерное распределение электрических зарядов в ней, что делает молекулу воды полярной. Две поделенные электронные пары участвуют в образовании двух полярных ковалентных связей, а оставшиеся две неподеленные пары электронов тоже играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга Это приводит к тому, что молекула приобретает форму искаженного тетраэдра с атомом кислорода в центре. В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов. Но если смотреть только по центрам атомов, то получается, что молекула воды имеет угловое строение, причем угол Н–О–Н составляет примерно 105 градусов.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженныматомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз)
Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 оС) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.
Ассоциация (от лат. accosiare — соединять) — объединение простых молекул или ионов в более сложные, не вызывающие изменения химической природы вещества. Различают ассоциацию ионов и ассоциацию молекул. Образование ионных ассоциатов основано на проявлении электростатических сил. Простейшие ионные ассоциаты состоят из двух или трехионов и представляют собой нейтральные или заряженные частицы.
Ассоциация молекул воды происходит вследствие высокой их полярности, а также за счет образования водородных связей, которые возникают между водородом одной молекулы воды и кислородом другой молекулы.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
HOH↔H+ + OH-
Термическая диссоциация воды: 2H2O=2H2+O2 при(1000о)
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
2K + 2H2O = H2 + 2KOH (бурно)
3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O = H2 + CO (при сильном нагревании)
CH4 + 2H2O = 4H2 + CO2 (при сильном нагревании)
2) Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
SO2 + H2O = H2SO3
сернистая кислота
SO3 + H2O = H2SO4
серная кислота
CO2 + H2O = H2CO3
угольная кислота
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
CaO
+ H2O = Ca(OH)2
гидроксид кальция (гашеная известь)
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мы уже встречались с такими оксидами. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
CuSO4 + 5 H2O = CuSO4.5H2O
вещество белого цвета (безводный сульфат меди) кристаллогидрат (медный купорос), синие кристаллы
Приведем другие примеры образования гидратов:
H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
Аквакомплексы представляют собой ионы или молекулы, в которых лигандами служат молекулы воды. В водных растворах солей почти все ионы существуют в виде акваионов, например, [Be(H2O)4]2+, [Al(H2O)6]3+, [Cr(H2O)6]3+ и т.д. При кристаллизации таких солей из водных растворов вода остается связанной с комплексообразователем:
[Be(H2O)4]SO4, [K(H2O)6][Al(H2O)6](SO4)2, [Cr(H2O)6]Cl3.
К аквакомплексам относятся многие кристаллогидраты, например, [Al(H2O)6]Cl3 (иначе – AlCl3. 6 H2O), [Cr(H2O)6](NO3)3 (иначе – Cr(NO3)3. 6 H2O).
71. Олово. Электронная конфигурация атома. Отношение к кислотам и щелочам. Свойства
соединений олова(II) и олова(IV).
Sn
Олово — редкий рассеянный элемент.Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Полная Эл. конфигурация атома:1s 22s 22p 63s 23p64s 23d104p65s24d105p2
не полная конф. атома:[Kr] 4d10 5s2 5p2
Олово обладает высокой химической стойкостью.
Концентрированные растворы щелочей растворяют олово только при нагревании,медленно:
.Sn+NaOH=H2+Na2(Sn(OH)4) (лучше добавлять H2O2-пойдет до(OH)6)
кислоты: Sn+HCl(р)=H2+SnCl2(медл)
Sn+HCl(конц)=H2(SnCl4)+H2(причина Н2)
Sn+H2SO4(р)=SnSO4+H2(медл)
Sn+H2SO4(конц)=Sn(SO4)2+H2O+SO2
Sn+HNO3(р)=Sn(NO3)2+NO+H2O
Sn+HNO3(конц)=H2SnO3+NO2+H2O(xSnO2*yH2O)
Ст.о. +4:
SnCl4 + NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl
SNCl4 + 4H2O = Sn(OH)4 + 4HCl
SnF4 + 2KF = K2[SnF6]
Ст.О.+2:
SnO2 + 2KOH + 2H2O = K2[SN(OH)6]
Sn(OH)2 + 2HCl = SnCl2 + 2H2O
2Sn(OH)2 + 2NaOH = Na2[Sn(OH)4](Na2[Sn(OH)3])
SnS + (NH4)2S2 = SnS2 + (NH4)2S
SnS2 + (NH4)2S → (NH4)2SnS3
SnCl2+H2O=SnOHCl|+HCl
SnCl2+Na2CO3+H2O=Sn(OH)2|+CO2+NaCl+СO2(взаимн.усилен.гидрролиза)
H2[SnCl4]+H2O=SnOHCl+HCl
72.Скорость химической реакции. Факторы, влияющие на величину скорости реакции. Уравнение Аррениуса.
Скорость химической реакции - это изменение концентрации реагирующих веществ в единицу времени.
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, присутствие в системе катализаторов.
1)Зависимость скорости реакции от концентраций реагирующих веществ. Необходимым условием того, чтобы между частицами исходных веществ произошло химическое взаимодействие, является их столкновение друг с другом (соударение).Число соударений, в свою очередь, тем больше, чем выше концентрация каждого из исходных веществ или, что то же самое, чем больше произведение концентраций реагирующих веществ. Так, скорость реакции А+В=С,если А и В представить как [ A ]и [ B ] - молярные концентрации реагирующих веществ,то взаимодействие двух разных молекул, зависимость имеет вид:
V = k*[A]*[B] Реакция называется бимолекулярной.
k- коэффициент пропорциональности, называемый константой скорости данной реакции.
Полученное соотношение выражает закон действия масс для химической реакции, протекающей при столкновении двух частиц: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Этот закон открыт опытным путем К. Гульдбергом и П. Вааге (Норвегия) в 1867 г.
Если в элементарном акте участвует лишь одна молекула (при реакции разложения), зависимость будет иметь такой вид: n = k*[A]
В случае соударения трех молекул справедливо выражение: n = k*[A]*[B]*[C]
Обозначения коэффициентов:n - скорость реакции;[А], [В], [С] - концентрации реагирующих веществ;k - коэффициент пропорциональности; называется константой скорости реакции.
В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собой постоянную величину и поэтому входит в константу скорости. Например, для реакции горения угля:С+О2=СО2, закон запишется так: V= k*[O2] т.е. [C]=1!!!
2)Зависимость скорости реакции от температуры. Скорость большинства реакций увеличивается с ростом температуры, так как при этом возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение. Для количественного описания температурных эффектов в химической кинетике используют два основных соотношения – правило Вант-Гоффа и уравнение Аррениуса.
Вант-Гофф сформулировал правило: повышение температуры на каждые 10 о С приводит к увеличению скорости реакции в 2-4 раза (эту величину называют температурным коэффициентом реакции).
v2 = v1*y (T1-T2)/10.
v - скорость реакции.
y (гамма) - температурный коэффициент скорости - число, характеризующее ускорение реакции при нагревании на 10 градусов.
ΔT - разность температур.
3) Скорость реакции зависит от природы реагирующих веществ. Зависимость скорости от природы проявляется в зависимости от свойств самих веществ (твердость, энергоотрицательность и т.д.).
4)Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Явление изменения скорости реакции под действием таких веществ называется катализом. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем эти стадии энергетически более доступны. Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов, возникающих без катализатора. Таким образом, энергия активации резко понижается: некоторые молекулы, энергия которых была недостаточна для активных столкновений, теперь оказываются активными.
Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. Катализ можно представить следующим образом: А + К = А...К А...К + В = АВ + К, где А...К - промежуточное активированное соединение.
Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной фазы.
Примеры гомогенного катализа: 1) окисление SO2 + 1/2O2 = SO3 в присутствии NO; NO легко окисляется до NO2, а NO2 уже окисляет SO2;
Гомогенный катализ осуществляется через промежуточные реакции с катализатором, и в результате происходит замена одной реакции с высокой энергией активации несколькими, у которых энергии активации ниже, скорость их выше:
CO + 1/2O2 = CO2 (катализатор - пары воды).
Широкое применение в химической промышленности находит гетерогенный катализ. При гетерогенном катализе реакция протекает на поверхности катализатора. Отсюда следует, что активность катализатора зависит от величины и свойств его поверхности. Для того чтобы иметь большую («развитую») поверхность, катализатор должен обладать пористой структурой или находиться в сильно раздробленном (высокодисперсном) состоянии.
Как и в случае гомогенного катализа, при гетерогенном катализе реакция протекает через активные промежуточные соединения. Но здесь эти соединения представляют собой поверхностные соединения катализатора с реагирующими веществами. Проходя через ряд стадий, в которых участвуют эти промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор в результате не расходуется.
Все каталитические гетерогенные реакции включают в себя стадии адсорбции и десорбции.
Примеры гетерогенного катализа:
2H2O = 2H2O + O2 (катализатор – MnO2,);
Н2 + 1/2 О2 = Н2О (катализатор - платина).
Очень большую роль играет катализ в биологических системах. Большинство химических реакций, протекающих в пищеварительной системе, в крови и в клетках животных и человека, являются каталитическими.реакциями. Катализаторы, называемые в этом случае ферментами, представляют собою простые или сложные белки. Так, слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар. Фермент, имеющийся в желудке, — пепсин — катализирует расщепление белков. В организме человека находится около 30 000 различных ферментов: каждый из них служит эффективным катализатором соответствующей реакции.
Резко замедлить протекание нежелательных химических процессов в ряде случаев можно, добавляя в реакционную среду ингибиторы (явление «отрицательного катализа»).
Ингибитор ( лат. inhibere — задерживать) — вещество, замедляющее или предотвращающее течение какой-либо химической реакции: коррозии металла, старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др.
Особое практическое значение имеют ингибиторы коррозии металла. По современным представлениям, механизм действия ингибиторов коррозии имеет электрохимическую природу. Применительно к коррозии металла ингибитором называют вещество, которое,адсорбируясь на поверхности металла, делает её потенциал положительнее, тем самым замедляя процесс коррозии.
Уравнение Арениуса:
Превращение исходных частиц в продукты реакции, как правило, связано с преодолением потенциального барьера, который называют энергией активации химической реакции (Е).
Наличие потенциального барьера обусловлено тем, что каждая частица (молекула, радикал, ион) – энергетически более или менее устойчивое образование. Перестройка реагирующих частиц требует разрыва или ослабления отдельных химических связей, на что необходимо затратить энергию. Впервые зависимость k от Т выведена Аррениусом из экспериментальных данных. Она имеет вид:
k=Ae–E/RT
В эту формулу входят два параметра: энергия активации Е и предэкспоненциальный множитель (предэкспонента) А- частотный множитель. Энергия активации Е есть тот минимальный избыток энергии, которым должна обладать частица (или пара реагирующих частиц), чтобы вступить в химическую реакцию. Экспонента е–E/RTпредставляет собой долю активных частиц или активных столкновений частиц, приводящих к реакции.R- универсальная постоянная газовая T-температура.
73. Хлор. Получение в промышленности и в лаборатории. Химические свойства и применение хлора. Диспропорционирование хлора в щелочной среде на холоду и при нагревании. Взаимодействие хлора с другими галогенами.
В свободном виде — желто-зеленый тяжелый газ с резким удушливым запахом (отсюда название: греч. chloros — желто-зеленый).Важнейшее химическое соединение хлора — поваренная соль (химическая формула NaCl, химическое название хлорид натрия) — было известно человеку с древнейших времен.Конфигурация внешнего электронного слоя 3 s2p5. В соединениях проявляет главным образом степени окисления –1, +1, +3, +5 и +7 (валентности I, III, V и VII).
Получение:
(в пром-ти) При этом за счет процесса электролиза NaCl:
2NaCl + 2H2O = 2NaOH + H2 + Cl2 получают сразу три ценных химических продукта: на аноде — хлор, на катоде — водород, и в электролизере накапливается щелочь.
(в лаб.)Для получения хлора в лаборатории используют реакцию концентрированной соляной кислоты с каким-либо сильным окислителем (перманганатом калия KMnO4, дихроматом калия K2Cr2O7, хлоратом калия KClO3, хлорной известью CaClOCl, оксидом марганца (IV) MnO2 , K2СrO4, NaBiO3, PbO2,). Наиболее удобно использовать для этих целей перманганат калия: в этом случае реакция протекает без нагревания:
2KMnO4 + 16HCl = 2KСl + 2MnCl2+ 5Cl2+ 8H2O.
Свойства:
Cl2 + H2O = HCl + HOCl (если вода холодная – Cl2 реагирует наполовину)
Cl2 + KOH = KCl + KOCl (при нагревании процесс идёт глубже, вместо KOCl – KOCl3)
Взаимодействие с металлами:без нагревания хлор реагирует с щелочными и щелочноземельными металлами, с сурьмой:
2Sb + 3Cl2 = 2SbCl3
При нагревании хлор реагирует с алюминием:3Сl2 + 2Аl = 2А1Сl3
и железом:2Fe + 3Cl2 = 2FeCl3.
Взаимодействие с неметаллами:
S + Cl2 = SCl2
Cl2+H2=(сжигание в темн)2HCl
P + Cl2 = PCl3 (если хлора мало, а если много, то получается PCl5)
C + Cl2 = CCl4
Непосредственно хлор не реагирует с кислородом, азотом, углеродом (многочисленные соединения хлора с этими элементами получают косвенными путями) и инертными газами.
SO2 + Cl2 = SO2Cl2
Cl2+NaBr=NaCl+Br2
Хлор применение: используют для получения дезинфицирующих и отбеливающих средств (гипохлорита натрия, хлорной извести и других), соляной кислоты, хлоридов многих металлов и неметаллов, многих пластмасс (поливинилхлорида и других), хлорсодержащих растворителей (дихлорэтана СН2СlСН2Сl, четыреххлористого углерода ССl4 и др.), для вскрытия руд, разделения и очистки металлов и т.д. Хлор применяют для обеззараживания воды и других целей.
Диспропорционирование:
Cl2 + 2NaOH = NaCl + NaClO +H2O (на холоду)
3Cl2 + 6NaOH = 5NaCl + NaClO3 + 3H2O (при нагревании)
Взаимодействие с другими галогенами:
Br2 + Cl2 = 2BrCl (не ClBr, потому что Cl электроотрицательнее Br)
I2 + 3Cl2 =2 ICl3
Cl2 + 3F2 = 2ClF3(ClF5,ClF) если +H2O=HClO2(..)+HF
5F2 + Cl2 = 2ClF5
74. Перманганат калия как окислитель в кислой, нейтральной и щелочной средах. Приведите примеры реакций.
Перманганат калия – наиболее часто применяемый окислитель. Для окисления применяют водные (иногда ацетоновые) растворы KMnO4в нейтральной, кислой или щелочной среде.
Кислая среда (обесцвечивание раствора).
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + К2SO4 + 3H2O
Восстановитель: SO32- + H2O → SO42- + 2H+ 5
Окислитель: MnO4- + 8H+ → Mn2+ + 4H2O 2
Щелочная среда (раствор зелёного цвета).
Na2SO3 + 2KMnO4 + 2KOH → Na2SO4 + 2K2MnO4 + H2O
SO32- + MnO4- + OH- → SO42- + MnO42- + H2O
Восстановитель: SO32- + 2OH- - 2ē → SO42- + H2O 1
Окислитель: MnO4- + 1ē →MnO42- 2
SO32- + 2OH- + 2MnO4- → SO42- + H2O + 2MnO42-
Нейтральная среда (бурый осадок).
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2↓ + 2KOH
SO32- + MnO4- + H2O → SO42- + MnO2↓ + 2OH-
Восстановитель: SO32- + H2O -2ē → SO42- + 2H+ 3
Окислитель: MnO4- + 2H2O + 3ē → MnO20↓ + 4OH- 2
75.Основные положения теории кристаллического поля. Расщепление энергетических уровней d-орбиталей в поле лигандов. Высоко- и низкоспиновые комплексы.
Теория кристаллического поля основана на предположении, что между комплексообразователем и лигандами осуществляется ионная связь. Однако в отличие от классических электростатических представлений в теории кристаллического поля учитывается влияние электростатического поля лигандов на энергетическое состояние электронов комплексообразователя.
Первоначально ТКП была применена к кристаллам, а затем перенесена на комплексные соединения.
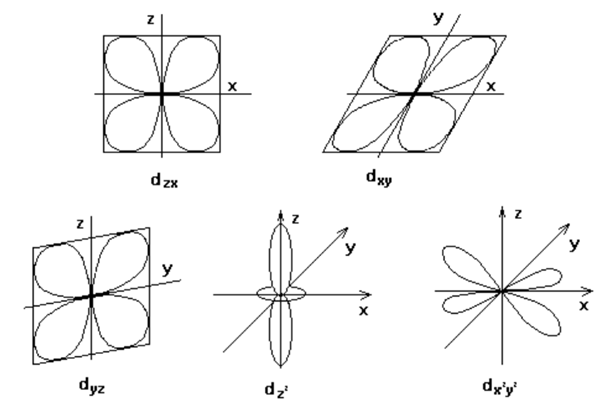
Лиганды, как отрицательные заряды, создают вокруг комплексообразователя электростатическое поле, в котором d-подуровни энергии комплексообразователя расщепляются. Чем сильнее октаэдрическое поле лигандов, тем больше величина параметра расщепления. В зависимости от силы поля лигандов заселение орбиталей электронами идёт по-разному. В сильном поле сначала полностью заселяются dxy, dxz, dzy – орбитали, а затем dz2 и dx2-y2 –орбитали. В слабом поле идёт последовательное заселение d-орбиталей в соответствии с правилом Хунда.
Электронные конфигурации d-орбиталей с максимальным числом неспаренных электронов получили название высокоспиновых, а с минимальным числом неспаренных электронов – низкоспиновых. Высокоспиновые образуются в слабом поле, низкоспиновые – в сильном.
Рассмотрим октаэдрическое строение комплексных связей. При октаэдрическом окружении комплексообразователя наиболее близко к вершинам октаэдра располагаются 3dz2 и 3dx2y2 орбитали. Следовательно, в этом случае силы отталкивания возрастают в большей степени, чем для остальных 3d-орбиталей, которые располагаются дальше от вершины октаэдра(3dyz, 3dxy, 3dyz орбитали).
Наблюдается следующее расщепление энергетических уровней:
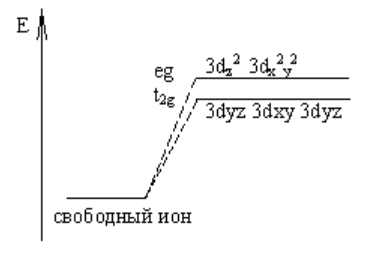
При образовании донорно-акцепторной связи пары электронов от лигандов переходят на свободные орбитали комплексообразователя. Причем в первую очередь будут заполняться те орбитали, у которых уровень энергии ниже. При октаэдрическом окружении в первую очередь начнут заполняться 3dyz, 3dxy, 3dyz орбитали.
При тетраэдрическом окружении комплексообразователя оказывается, что ближе к вершинам тетраэдра располагаются 3dyz, 3dxy, 3dyz орбитали. Следовательно, они будут обладать более высоким энергетическим уровнем, чем 3dz2 и 3dx2y2 орбитали. В этом случае расщепление энергетического уровня будет выглядеть следующим образом:
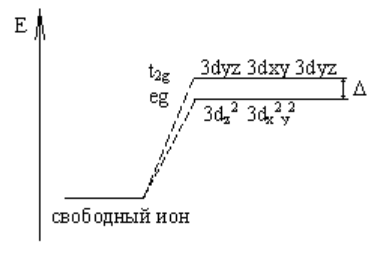
Delta - энергия расщепления энергетических уровней.
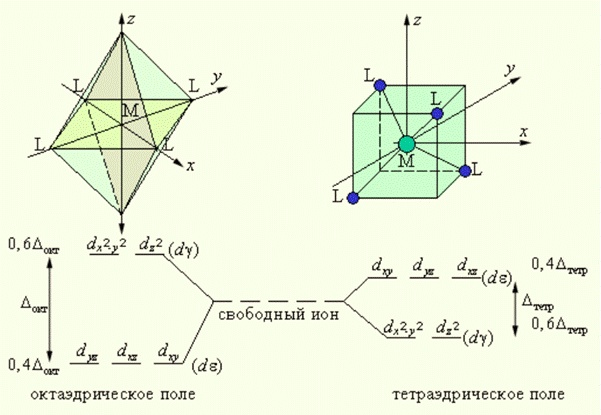
Из рисунка следует, что заселение любой dε-орбитали одним электроном приводит к уменьшению на 0,4Δокт энергии октаэдрического комплекса, т. е. стабилизирует его по сравнению со свободным (сферически симметричным) ионом, а заселение электроном любой из dγ-орбиталей этот комплекс дестабилизирует на 0,6Δокт. В тетраэдрическом поле порядок расщепления d-орбиталей будет обратным, а потому энергия стабилизации на один электрон будет 0,6 Δтетр, а дестабилизации – 0,4 Δтетр
Энергия расщепления энергетических уровней зависит от природы лигандов. Существуют лиганды, оказывающие более сильное действие (сильное поле лигандов), а есть такие, которые оказывают более слабое действие (слабое поле лигандов). В соответствии с этим, все лиганды располагают в определенный ряд, называемый электрохимический ряд лигандов:
I- < Br- < Cl- < SCN- < NO3- < F- < OH- < H2O < NCS- < H- < NH3 < NO2- < CN- < CO
В октаэдрических комплексах, образуемых ионами с электронными конфигурациями d4, d5, d6, d7, возможно различное размещение электронов – либо высоко-, либо низкоспиновое в зависимости от параметра расщепления Δ и энергии спаривания P. Последняя определяется как разность энергий межэлектронного взаимодействия низкоспиновой (НС) и высокоспиновой (ВС) конфигураций, деленная на число спаривающихся электронов. Очевидно, что низкоспиновое состояние реализуется тогда, когда P < Δ, а высокоспиновое – когда P > Δ.
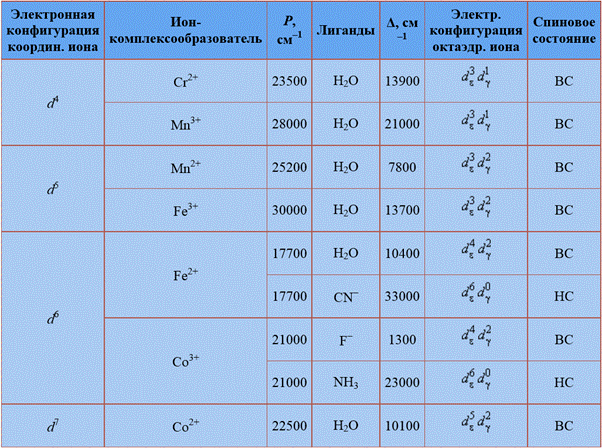
В рамках ТКП высокоспиновый комплекс 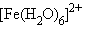 с электронной конфигурацией
с электронной конфигурацией 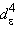
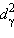 будет менее устойчив, чем низкоспиновый
будет менее устойчив, чем низкоспиновый 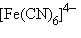 (электронная конфигурация
(электронная конфигурация 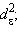 ).
).
Распределение электронов между нижним (dγ) и верхним (dε) уровнями в тетраэдрических комплексах также зависит от соотношения Δ и P, но поскольку Δтетр < Δокт, тетраэдрические комплексы обычно остаются высокоспиновыми.
В отличие от метода валентных связей, ТКП, основываясь на электронной конфигурации центрального атома, положении лигандов в спектрохимическом ряду и симметрии комплекса, позволяет не только объяснять, но и предсказывать магнитные и спектроскопические свойства комплексов.
76. Алюминий, нахождение в природе. Получение металлического алюминия. Положение в электрохимическом ряду напряжений металлов. Отношение к кислотам и щелочам. Оксид, гидроксид и их свойства. Алюмотермия. Комплексные соединения алюминия.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al +13)2)8)3, p – элемент,
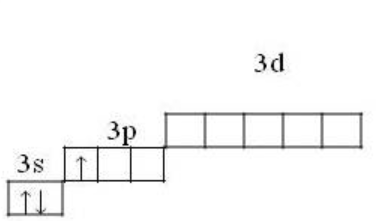
Основное состояние
1s22s22p63s23p1
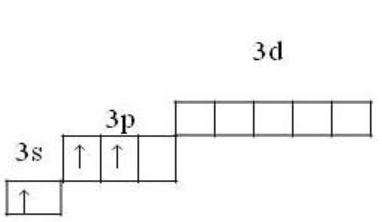
Возбуждённое состояние
1s22s22p63s13p2
По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов, на его долю приходится около 8,8% массы земной коры. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др Изредка встречается исключительно твердый (уступает лишь алмазу) минерал корунд – кристаллический оксид Al2O3, часто окрашенный примесями в разные цвета. В качестве микроэлемента алюминий присутствует в тканях растений и животных. В природе алюминий существует в виде бокситов Al2O3*n H2O (с примесями SiO2, Fe2O3, CaCO3), нефелина (Na, K)2O* Al2O3*2 SiO2, криолит Na3(AlF6).Обладает высокой поляризующей способностью.Исходя из положения алюминия в электрохимическом ряду напряжений металлов можно сказать, что он обладает химической активностью и поэтому не встречается в природе в свободном состоянии.
Получение алюминия.
Металлический алюминий впервые был получен в 1825 году датским физиком Эрстедом в результате двустадийного процесса:
1) Al2O3 + 3Cl2 + 3C = 2AlCl3 + 3CO
2) AlCl3 + 3K(р-р в Hg) = Al + 3KCl
Одним из способов получения алюминия является электролиз глинозема Al2O3 в расплавленном криолите Na3AlF6 при температуре 950 градусов. Процесс электролиза Al2O3 можно представить схемами:
1) диссоциация Al2O3 в расплаве:
Al2O3 = Al3+ + AlO33-
2) электролиз:
на катоде Al3+ + 3e = Al
на аноде 4AlO33- - 12e = 2Al2O3 + 3O2
Криолит в ходе реакции не расходуется.
Положение алюминия в ряду напряжений определяет его высокую электрохимическую активность. Нормальный электродный потенциал алюминия равен - 1 34 в; поэтому алюминий должен исключительно быстро подвергаться коррозии и быть малопригодным для изготовления из него химической аппаратуры. Несмотря на это, алюминий является металлом, обладающим высокой химической стойкостью в ряде агрессивных сред, и часто по своим антикоррозионным свойствам стоит выше некоторых электроположительных металлов. Причина этого лежит в большой склонности алюминия к образованию в присутствии окислителей плотной защитной пленки, потенциал которой значительно выше потенциала металла.
Взаимодействие с кислотами:
С раствором серной кислоты: 2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) = Аl(NO3)3 + 3NO2 + 3Н2О.
2Al + 6HF = 2AlF3 + 3H2
Взаимодействие со щелочами.
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
При повышении концентрации щелочи:
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] +3H2
Оксид алюминия Al2О3
Белое твердое вещество, нерастворимое в воде, температура плавления 20500С.
Природный А12О3 - минерал корунд. Прозрачные окрашенные кристаллы корунда - красный рубин – содержит примесь хрома - и синий сапфир - примесь титана и железа - драгоценные камни. Их получают так же искусственно и используют для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п.
Оксид алюминия проявляет амфотерные свойства
1. взаимодействие с кислотами
А12О3 +6HCl = 2AlCl3 + 3H2O
2. взаимодействие со щелочами
А12О3 + 2NaOH – 2NaAlO2 + H2O
Al2O3 + 2NaOH + 5H2O = 2Na[Al(OH)4(H2O)]
3. взаимодействие с солями, имеющими сильнощелочную среду, вследствие гидролиза
Al2O3 + Na2CO3 = 2 NaAlO2 + CO2
Гидроксид алюминия А1(ОН)3
А1(ОН)3 представляет собой объемистый студенистый осадок белого цвета, практически нерастворимый в воде, но легко растворяющийся в кислотах и сильных щелочах. Он имеет, следовательно, амфотерный характер.
Получают гидроксид алюминия реакцией обмена растворимых солей алюминия со щелочами
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Al3+ + 3OH- = Al(OH)3↓
Данную реакцию можно использовать как качественную на ион Al3+
1. взаимодействие с кислотами
Al(OH)3 +3HCl = 2AlCl3 + 3H2O
2. при взаимодействии с сильными щелочами образуются соответствующие алюминаты:
NaOH + А1(ОН)з = Na[A1(OH)4]
3. термическое разложение
2Al(OH)3 = Al2О3 + 3H2O
Соли алюминия подвергаются гидролизу по катиону, среда кислая (рН < 7)
Al3+ + Н+ОН- ↔ AlОН2+ + Н+
Al(NO3)3 + H2O↔ AlOH(NO3)2 + HNO3
Растворимые соли алюминия и слабых кислот подвергаются полному (необратимому гидролизу)
Al2S3+ 3H2O = 2Al(OH)3 +3H2S
Алюминотермия (алюмотермия) — способ получения металлов, неметаллов (а также сплавов) восстановлением их окислов металлическим алюминием:
2Al + Cr2О3 = Al2О3 + 2Cr
Реакция открыта в 1859 г. русским химиком Н. Н. Бекетовым. При данной реакции выделяется большое количество теплоты. Алюминотермия применяется для получения хрома, ванадия, марганца, вольфрама и других металлов и сплавов.
Комплексные соединения алюминия
Экспериментально доказано существование гидроксомплексов [Аl(ОН)4(Н2О)2]-, [Аl(ОН)6]3-, [Аl(ОН)5(Н2O)]2-; из них
первый — наиболее прочный. Координационное число алюминия в этом комплексе равно 6, т.е. алюминий является шестикоординированным.
[Al(OH2)6]3+ + OH- = [Al(OH)(OH2)5]2+ + H2O
[Al(OH)(OH2)5]2+ + OH- = [Al(OH)2(OH2)4]+ + H2O
[Al(OH)2(OH2)4]+ + OH- = [Al(OH)3(OH2)3] + H2O
В водной среде анион Al3+ непосредственно окружен шестью молекулами воды. Такой гидратированный ион несколько диссоциирован по схеме:
[Al(OH2)6]3+ + H2O = [Al(OH)(OH2)5]2+ + H3O+
Прочие свойства комплексов алюминия
a) нефелин и известняк спекают в трубчатых печах при 1200оС:
(Na,K)2[Al2Si2O8] + 2CaCO3 = 2CaSiO3 + NaAlO2 + KAlO2 + 2CO2
б) образовавшуюся массу выщелачивают водой - образуется раствор алюминатов натрия и калия и шлам CaSiO3:
NaAlO2 + KAlO2 + 4H2O = Na[Al(OH)4] + K[Al(OH)4]
в) через раствор алюминатов пропускают образовавшийся при спекании CO2:
Na[Al(OH)4] + K[Al(OH)4] + 2CO2 = NaHCO3 + KHCO3 + 2Al(OH)3
г) нагреванием Al(OH)3 получают глинозем:
2Al(OH)3 = Al2O3 + 3H2O
При взаимодействии AlH3 с основными гидридами в эфирном растворе образуются гидроалюминаты:
LiH + AlH3 = Li[AlH4]
77. Азот. Причины его химической инертности. Способы связывания атмосферного азота. Получение азотной кислоты в промышленности.

Из-за наличия трёх неспаренных электронов азот очень активен, проявляет в соединениях степени окисления от «-3» до «+5».
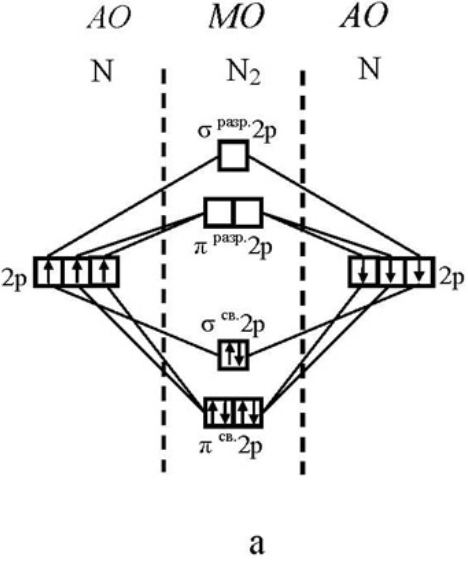
Кратность связи равна (6-2)/2 = 3. Энтальпия тройной связи составляет -940,5кДж/моль. Это одна из самых прочных молекул. Жидкий и твердый азот также построены из молекул N2, связанных силами Ван-дер-Ваальса. Прочность и неполярность молекулы N2, близость энтальпии ионизации молекулы(1402 кДж/моль) к энтальпии ионизации аргона объясняют ее химическую инертность по отношению к многим веществам.
Способы связывания атмосферного азота
Высокая энергия связи в молекуле азота обеспечила особый технологический режим проведения процессов с участием атмосферного азота:
- применение высоких температур;
- высоких давлений;
 2018-01-21
2018-01-21 11211
11211
