В химической термодинамике имеется соотношение, которое связывает энергию Гиббса с константой равновесия. Это широко известное уравнение Вант-Гоффа, которое записывается в ленейном и экспотенциальном виде:
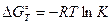 или
или 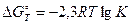
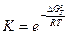 или
или 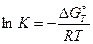
Рассчитав величину DG0298 химической реакции, можно определить константу равновесия. Из уравнения (4.13) следует, что если величина DG0 отрицательна, то lgК должен быть положительным, что, в свою очередь, означает, что К >1. И наоборот, если DG0 > 0, то К <1.
Пример 13. Прямая или обратная реакция будет протекать при стандартных условиях в системе:
 CH4(г) + СО2 (г) 2СО (г) + 2Н2 (г).
CH4(г) + СО2 (г) 2СО (г) + 2Н2 (г).
Запишите закон действия масс для этой реакции.
Решение: Для ответа на вопрос следует вычислить DG0298 или 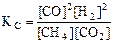 прямой реакции. Последнее выражение и есть ЗДМ. Значения DG0298 соответствующих веществ приведены в таблице 4.1. Зная, что значения DG0f для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, а значения DG0ƒ (в кДж/моль) для СO2 (-394,3), СН4 (-50,8) и СО (-137,1), используя уравнение (4.7), рассчитываем DG0х.р.:
прямой реакции. Последнее выражение и есть ЗДМ. Значения DG0298 соответствующих веществ приведены в таблице 4.1. Зная, что значения DG0f для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, а значения DG0ƒ (в кДж/моль) для СO2 (-394,3), СН4 (-50,8) и СО (-137,1), используя уравнение (4.7), рассчитываем DG0х.р.:
DG0х..р. = 2DG0ƒ,(СО) - DG0ƒ, (СН4) - DG0ƒ, (СО2) = 2·(-137,1) - (-50,8 - 394,3) = +170,9 кДж = 170900 Дж.
После этого вычисляем константу равновесия
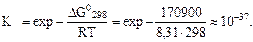
То, что DG > 0, а Kр << 1, указывает на невозможность самопроизвольного протекания прямой реакции при T = 298 К и равенстве давлений взятых газов
1,013 × 105 Па (760 мм рт.ст. или 1 атм.). Самопроизвольно при этих условиях будет протекать обратная реакция, т.к. для нее DG = -170,9 кДж, а К» 1037.
Пример 14. На основании стандартных энтальпий образования и абсолютных стандартных энтропий веществ (табл. 4.1) вычислите DG0298 реакции, протекающей по уравнению
 CO(г) + Н2О(ж) СО2 (г) + Н2 (г), DН0ƒ, (кДж/моль) -110,5 -285,8 -393,5 0S0 (Дж/моль · К) 197,5 70,1 213,6 130,6
CO(г) + Н2О(ж) СО2 (г) + Н2 (г), DН0ƒ, (кДж/моль) -110,5 -285,8 -393,5 0S0 (Дж/моль · К) 197,5 70,1 213,6 130,6
Запишите закон действующих масс и вычислите Kp.
Решение:
1) DН0 = (-393,5 + 0) - (-110,5 - 285,8) = + 2,80 кДж.
2) DS0 = (213,6 + 130,6) - (197,5 + 70,1) = 0,0766 кДж/моль.
3) DG0 = +2,80 - 298·0,0766 = -20,0 кДж.
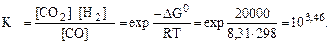
Концентрация Н2О(ж) принимается равной 1 и не включена в ЗДМ, т.к. это конденсированное состояние.
Пример 15. Реакция восстановления Fe2O3 водородом протекает по уравнению
Fe2O3 (к) + 3H2 = 2Fe (к) + 3Н2О(г); DHо = + 96,61кДж.
Запишите закон действующих масс для этой реакции. Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS0 = 0,1387 кДж/моль·К? При какой температуре начнется восстановление Fe2O3? Каково значение К при этой температуре?
Решение. Вычисляем DG0 реакции:
DG0 = DH0 - TDS0 = 96,61 - 298·0,1387 = 55,28 кДж.
ЗДМ для этой реакции c учетом агрегатного состояния веществ: 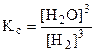 .
.
В то же время
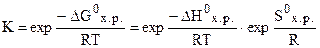 =
=
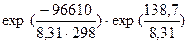
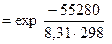 =
=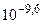 .
.
Так как DG >0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG = 0. При этом DH0 = TDS0, отсюда
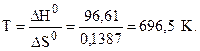
Следовательно, при температуре примерно 696,5 К начнется реакция восстановления Fe2O3. (“Примерно” потому, что при решении задачи мы не учитываем слабую зависимость DН и DS от температуры, а также то обстоятельство, что условие К < 1 означает не полное отсутствие реакции, а лишь малую степень её протекания). Иногда эту температуру называют температурой начала реакции. Подставляя в выражение для К значение Т = 696,5 К, убеждаемся, что К = 1.
Это значит, что за температуру начала реакции принята температура, при которой [H2O] = [H2].
 Пример 16. Константа равновесия системы H2 + I2 2HI при некоторой температуре равна 40. Определить, какая часть водорода и иода (%) перейдет в HI, если исходные концентрации этих веществ одинаковы и составляют 0,01 моль/л, а [HI]исх = 0.
Пример 16. Константа равновесия системы H2 + I2 2HI при некоторой температуре равна 40. Определить, какая часть водорода и иода (%) перейдет в HI, если исходные концентрации этих веществ одинаковы и составляют 0,01 моль/л, а [HI]исх = 0.
Решение. При решении подобных задач используется стехиометрическое уравнение реакции. Обозначим через x расход водорода к моменту наступления равновесия. Следовательно, равновесная концентрация Н2 составит [H2]p =
(0,01 - x). Так как I2 расходуется столько же, сколько и H2 (по уравнению на 1 моль H2 расходуется 1 моль I2), то [I2]p = (0,01 - x). Из уравнения видно, что к моменту равновесия HI получается в 2 раза больше, чем расходуется H2 , следовательно,
[HI]p = 2x. Запишем выражение для константы равновесия и подставим числовые значения равновесных концентраций:
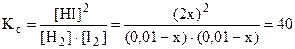 .
.
Уравнение имеет два корня: х1 = 0,0146, х2 = 0,0076. Из двух значений х следует выбрать то, которое отвечает условию задачи. Исходные концентрации Н2 и I2 равны 0,01 моль/л. Следовательно, х не может иметь значение больше 0,01 и решение имеет одно значение -0,0076 моль/л. Таким образом, из 0,01 моль Н2 и I2 прореагировало 0,0076 моль, что составляет 76 %.
 Пример 17. В системе CO + Cl2 COCl2 равновесные концентрации веществ составляют [CO2]p = 0,3; [CO]p = 0,2; [COCl2]p = 1,2 моль/л. Вычислить константу равновесия системы и исходные концентрации CO и Cl2.
Пример 17. В системе CO + Cl2 COCl2 равновесные концентрации веществ составляют [CO2]p = 0,3; [CO]p = 0,2; [COCl2]p = 1,2 моль/л. Вычислить константу равновесия системы и исходные концентрации CO и Cl2.
Решение. Найдем константу равновесия, подставив числовые значения равновесных концентраций в выражение константы равновесия:
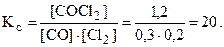
Исходная концентрация реагента равна сумме равновесной и израсходованной к моменту равновесия. Из уравнения реакции видно, что для образования 1 моль COCl2 расходуется по 1 моль СО и Cl2. Следовательно,
[CO]исх = [CO]p + [CO]изр = 0,2 + 1,2 = 1,4 моль/л.
[Cl2]исх = [Cl2]p + [Cl2]изр = 0,3 + 1,2 = 1,5 моль/л.
 2014-02-02
2014-02-02 29528
29528
