АЛКИНЫ
Содержание главы:
1. Строение ацетиленов
2. Способы получения алкинов
3. Реакции алкинов с участием тройной связи
4. Реакции ацетиленов с сохранением тройной связи
Алкинами называют углеводороды, в молекулах которых имеется структурный фрагмент с тройной связью углерод-углерод. К алкинам часто применяют название ацетилены по названию первого члена гомологического ряда. Они образуют гомологический ряд с общей формулой CnH2n-2. По номеклатуре IUPAC в названиях алкинов применяется окончание "‑ин":
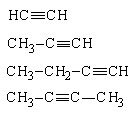 | Ацетилен (этин) |
| Метилацетилен (пропин) | |
| Этилацетилен (бутин-1) | |
| Диметилацетилен (бутин-2) |
Соответствующие алкинам одновалентные радикалы называются алкинил, пропаргил.
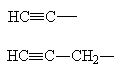 | Этинил |
| Пропаргил |
Для ацетиленов характерна структурная изомерия положения тройной связи в углеродной цепи и изомерия алкильных радикалов, связанных с алкинилом.
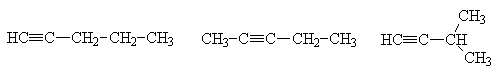 | ||
| Пентин-1 | Пентин-2 | Изопропилацетилен (3-метилбутин-1) |
в начало страницы
Строение ацетиленов
Атомы углерода в ацетилене имеют sp-гибридизацию и соединены одной s - и двумя p -связями. Поэтому молекула ацетилена линейна (валентный угол 180°). Длина связи С-С составляет 121 пм (для сравнения - в этане 154 пм, в этилене 134 пм), длина связи С-Н – 106 пм (в этане 110 пм, в этилене 107 пм).
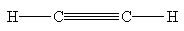
Энергия тройной углерод-углеродной связи равна 833 кДж/моль, что меньше, чем суммарная величина энергии для трех s -связей (339х3=1017 кДж/моль) и комбинации одной s - и двух p -связей (339+2х272=883 кДж/моль). Это можно рассматривать как результат отталкивания связывающих электронов трех связей, которые вынуждены быть сближенными в пространстве. Молекулу ацетилена можно представить себе в виде цилиндра, образованного орбиталями p -связей, из торцов которого выходят s -связи С-Н. Атомы водорода имеют более короткую связь с С-атомами, чем в алкенах и алканах, т.к. углеродный атом в гибридном состоянии sp наиболее электроотрицателен. Причина укорочения связи С-Н в алкинах по сравнению с алкенами и алканами состоит в том, что sp-орбиталь, как имеющая больший вклад s-характера (50%), изначально лежит ниже по энергии, чем sp2- (33.3%) и sp3- (75%) орбитали. Это приводит к увеличению прочности С-Н-связи в ацетиленах (энергия гомолитической диссоциации 502 кДж/моль) относительно прочности С-Н-связей в алканах и алкенах (414 кДж/мол и 439 кДж/моль соответственно). Ацетиленовый протон в значительной степени дезэкранирован, поскольку электронная пара смещена к атому углерода в большей мере, чем к таковым в гибридных состояниях sp2 и sp3. Можно рассматривать sp-гибридный С-атом как более электроотрицательный, чем атом углерода в других валентных состояниях.
Две вырожденные ВЗМО ацетилена (Е = -1088,6 кДж/моль) лежат ниже, чем ВЗМО этилена (Е = -963 кДж/моль).
Исходя из этих представлений, можно объяснить основные свойства ацетиленов:
– для ацетиленов характерными являются реакции электрофильного и нуклеофильного присоединения;
– терминальным алкинам свойственная повышенная С-Н-кислотность.
в начало страницы
Способы получения алкинов
В промышленности ацетилен применяется весьма широко и разработан способ его получения термолизом метана
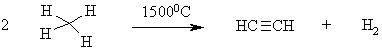
или гидрированием углерода при 3000 оС:

Реакцию проводят, используя электрическую дугу между угольными электродами в токе водорода, т.к. время нагревания должно быть очень коротким во избежание обратного процесса разложения ацетилена на элементы.
Существует также карбидный способ получения некоторых ацетиленов:

Эта реакция представляет собой фактически гидролиз ацетиленидов, которыми по сути являются карбиды металлов.
Среди лабораторных способов получения ацетиленов можно отметить разнообразные реакции элиминирования, среди которых чаще всего используют дегидрогалогенирование виц- дигалогенидов
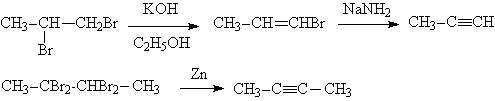
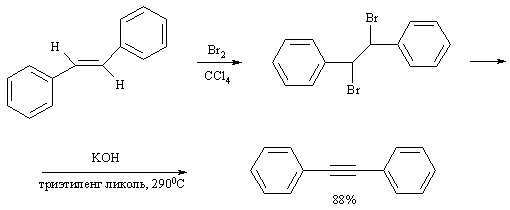
Нужно иметь в виду, что в щелочной среде алкины склонны к перегруппировкам с перемещением тройной связи:
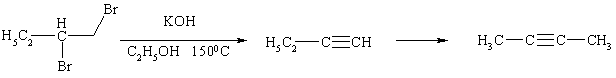
Поэтому для элиминирования рекомендуется использовать амид натрия в жидком аммиаке. В этих условиях образуются в основном терминальные ацетилениды, причем в качестве исходных можно применять и гем- дигалогениды:
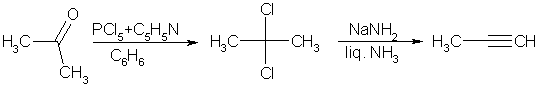
Другие способы синтеза подразумевают превращения одних алкинов в другие и будлут рассмотрены ниже.
в начало страницы
 2017-11-01
2017-11-01 1692
1692







