Горением называется сложный,самоподдерживающийся физико-химический процесс, представляющий собой окислительно-восстановительную реакцию, протекающую с большой скоростью и сопровождающуюся выделением тепла и излучением света.
Для горения необходимо наличие трѐх составляющих:

горючего вещества;

окислителя (кислород воздуха, озон, перекись водорода, галогены,
перманганат калия, хромовый ангидрид и т. д.)
 источника зажигания (открытое пламя, искры различного
источника зажигания (открытое пламя, искры различного
происхождения, высоко нагретые поверхности) или
благоприятствующего фактора (физико-химический или биологический процесс, протекающий с выделением тепла).
С точки зрения электронной теории, горение – это перераспределение валентных электронов между горючим веществом и окислителем.
Горючим веществом называется вещество,атомы(молекулы)которогоспособны отдавать в процессе реакции свои валентные электроны. Горючее вещество в процессе реакции окисляется, образуя продукты окисления.
Окислителем называется вещество,атомы(молекулы)которогоспособны присоединять валентные электроны в процессе реакции. Окислитель
в ходе реакции восстанавливается.
Процесс горения как одна из форм химического взаимодействия атомов и молекул может быть по-настоящему понятен только на основе изучения
молекулярно-кинетической теории строения материи. Необходимо представлять, что в химических процессах прежде чем образуются новые молекулы, разрушаются старые. Энергия, необходимая для разрыва связей в молекулах горючего и окислителя, называется энергией активации. Разрушение или ослабление химических связей в молекулах происходит под действием теплового движения атомов. Чем выше температура, тем выше доля активных молекул, тем эффективнее соударения и больше их число. Для реакции горения, как и для многих других химических реакций, справедливо положение: повышение температуры на 10 С приводит к увеличению еѐ скорости в 2–4 раза (правило Вант-Гоффа). Кроме того, скорость реакции, согласно закону действующих масс, увеличивается с возрастанием

концентрации реагентов. Скорость горения максимальна при стехиометрическом составе смеси – когда отношение реагентов соответствует коэффициентам в уравнении реакции.
В условиях пожара горение чаще всего протекает в среде воздуха. Для решения задач по определению основных параметров, характеризующих процесс горения, необходимо уметь составлять уравнения реакций горения горючих веществ в воздухе.
Обобщѐнная запись брутто-уравнения материального баланса реакции горения имеет вид:
| n ГВ[ГВ] + n ОК[ОК]= ∑ n ПГ i [ПГ], | (1) |
где n ГВ, n ОК, n ПГi – стехиометрические коэффициенты при соответствующих веществах: [ГВ] – горючее вещество, [ОК] - окислитель, [ПГ] – продукты горения.
Данное уравнение является обобщѐнным выражением материального баланса любой химической реакции окисления. Оно не несѐт информации о промежуточных стадиях процесса, которых может быть великое множество, а выражает только начальное и конечное состояние системы. Поэтому его называют также суммарным или брутто-уравнением реакции горения. Для решения многих инженерно-технических задач этого уравнения бывает достаточно.
При составлении уравнения материального баланса процессов горения принято учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. Воздух состоит из азота, кислорода, водорода, углекислого и инертных газов. При ведении теоретических расчѐтов водород, углекислый газ и инертные газы (их вместе взятых в воздухе около 1 %) причисляют к азоту, которого в воздухе 78 %. Поэтому можно принять, что воздух состоит из 21 % кислорода и 79 % азота. Нетрудно установить, что на 1 объѐм кислорода в воздухе приходится 3,76 объѐма азота (79: 21 = 3,76) или на 1 моль кислорода приходится 3,76 моля азота и, таким образом, состав воздуха в уравнениях реакций горения – (О2
+ 3,76 N2).
В реакции горения принимает участие только кислород. Азот в реакцию
не вступает и выделяется из зоны горения вместе с продуктами горения. В левой части уравнения реакции горения записывают горючее вещество и воздух, в правой части – продукты горения. При уравнивании левой и правой частей уравнения реакции горения коэффициент перед горючим веществом для упрощения расчѐтов параметров процесса горения, как правило, не ставят, т.е. принимают равным единице, в связи с чем коэффициент перед воздухом может получаться дробным.
Рассмотрим примеры составления уравнений реакций горения горючих веществ в воздухе.
ПРИМЕР: Составить уравнение реакции горения пентана (С5Н12) ввоздухе.
При горении углеводородов в воздухе продуктами горения будут углекислый газ (СО2), пары воды (Н2О) и азот (N2) из воздуха:
С5Н12 + (О2 + 3,76 N2) CО2 + Н2О + 3,76 N2.

Расставим коэффициенты в данном уравнении реакции так, чтобы число атомов каждого элемента в правой части уравнения было равно числу атомов этих элементов в левой части.
Углерода в молекуле пентана 5 атомов, следовательно, в продуктах горения образуется 5 молекул углекислого газа. Атомов водорода в молекуле пентана 12, следовательно в продуктах горения образуется 6 молекул воды, так как в молекуле Н2О два атома водорода (12: 2 = 6). В последнюю очередь уравнивается число атомов кислорода. Подсчитываем число атомов кислорода
в правой части уравнения: число атомов кислорода в 5 молекулах СО2 равно 10 (5  2 =10); число атомов кислорода в 6 молекулах воды равно 6 (6
2 =10); число атомов кислорода в 6 молекулах воды равно 6 (6  1 = 6). Всего
1 = 6). Всего
в правой части получается 16 атомов кислорода, следовательно в левой части перед скобкой мы должны поставить коэффициент, равный 8 (16: 2 = 8), т. к. в молекуле кислорода 2 атома. Коэффициент перед азотом в продуктах горения будет равен коэффициенту перед скобкой воздуха, умноженному на 3,76.
Окончательная запись уравнения реакции горения пентана в воздухе имеет вид
С5Н12 + 8 (О2 + 3,76 N2) = 5 CО2 + 6 Н2О +8 3,76 N2.

Коэффициент, стоящий перед скобкой воздуха, называется стехиометрическим коэффициентом реакции горения и обозначается. В нашем случае = 8.
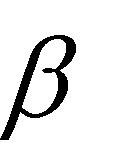
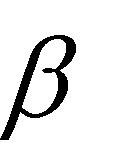
При горении кислородсодержащих соединений в воздухе уравнивание реакции происходит аналогично. Однако при уравнивании атомов кислорода нужно вычесть количество атомов кислорода, содержащихся в горючем веществе, из количества атомов кислорода в правой части уравнения реакции, а потом уже делить на 2.
Если в состав горючего вещества входит галоген и горючее вещество не содержит водород, то в продуктах горения он будет выделяться в свободном виде (Cl2, Br2 и т. д.). Если же горючее вещество содержит водород, то в продуктах горения он будет выделяться в соединении с водородом, например хлороводород (НCl).
Если в состав горючего вещества входит сера, алюминий, кремний и др., то в продуктах горения будут выделяться оксиды этих элементов (SO2, Al 2O3,
SiO2).
При горении веществ, содержащих азот, он выделяется в виде чистого газа азота (N2) и записывается отдельно от азота, содержащегося в воздухе.

C2H5Cl + 3(O2 + 3,76 N2) = 2 CO2 + 2 H2O + HCl + 3 3,76 N2; C4H4S + 6(O2 + 3,76 N2) = 4CO2 + 2 H2O + SO2 + 6 3,76 N2; CH3NH2 + 2,25(O2 + 3,76 N2) = CO2 + 2,5 H2O + 0,5 N2 + 2,25 3,76 N2.

 2017-10-25
2017-10-25 1733
1733
