Незважаючи на високу подібність базових механізмів роботи двох типів полімераз, що здійснюють синтез нуклеїнових кислот, існують принципові відмінності між ними. Головна особливість полягає в тому, що для ДНК-полімерази ДНК є одночасно й матрицею, і продуктом реакції, і це створює суттєві проблеми.
Оскільки при синтезі РНК в активному центрі РНК-полімерази тимчасово існує гібридна подвійна спіраль ДНК-РНК, РНК-полімераза може легко дискримінувати гібрид від звичайної подвійної спіралі ДНК. Висока спорідненість оточення активного центру РНК-полімерази до гібрида та каналу виходу транскрипту до РНК забезпечує високу процесивність ферменту – здатність працювати без дисоціації після однократного акту ініціації транскрипції. ДНК-полімераза має подвійну спіраль ДНК як у оточенні свого активного центру, так і скрізь поза полімеразним комплексом. Відповідно, існує висока ймовірність її дисоціації: процесивність ДНК-полімерази є дуже низькою – вона може синтезувати до дисоціації лише ділянку довжиною 10 – 20 нуклеотидів. Отже, має існувати певний додатковий механізм підвищення процесивності.
Висока спорідненість РНК-полімерази до гібрида ДНК-РНК дозволяє легко руйнувати подвійну спіраль ДНК по ходу руху полімерази при елонгації транскрипції – транскрипт просто витісняє нематричний ланцюг ДНК із дуплекса. Для ДНК-полімерази такий механізм є неможливим: дуплекси ДНК у комплексі з полімеразою та попереду від неї нічим не відрізняються один від одного, тобто ДНК-полімераза потребує наявності одноланцюгової матричної ДНК, яка має бути вилучена з подвійної спіралі.
Третя проблема полягає в тому, що ДНК-полімераза здатна робити тільки одну операцію – продовжувати (редагуючи) 3′-кінець ланцюга ДНК, вона не може ініціювати синтез, створити перший фосфодіефірний зв’язок. Це означає, що певна коротка ділянка має бути створена якось інакше, щоб далі ДНК-полімераза могла продовжувати її синтез. Таку ділянку, без якої неможлива робота ДНК-полімерази, називають праймером (primer). Насправді, корфермент РНК-полімерази також не здатен ініціювати синтез РНК: первинний короткий транскрипт синтезується лише за участі факторів ініціації, які допомагають додатково зафіксувати перші нуклеотиди в активному центрі. При синтезі ДНК було знайдено інше еволюційне рішення: роль праймера виконує коротка ділянка РНК, що синтезується специфічною ДНК-залежною-РНК-полімеразою – праймазою.
Використання саме РНК у ролі праймера на початку синтезу ДНК має важливе значення для підвищення точності синтезу. Короткі первинні ділянки неможливо синтезувати з дуже високою точністю. На подальших етапах реплікації РНК-праймери можна легко відрізнити від ДНК, вилучити та заповнити прогалини між сусідніми ділянками ДНК за допомогою ДНК-полімерази.
Отже, ДНК-полімераза є хоч і головним, але не достатнім елементом системи реплікації. У реплікативній вилці працює складний мультибілковий комплекс – реплісома, до якого крім двох молекул ДНК-полімерази входять компоненти, що забезпечують розплітання ДНК, підвищення процесивності та виконують інші важливі допоміжні операції.
Реплісома та інші елементи системи реплікації
Геліказа й білки SSB
Операція розплітання подвійної спіралі (тобто утворення реплікативної вилки) здійснюється ДНК-геліказами – АТР-залежні ферменти цього типу вже згадувались у зв’язку з транскрипцією тасплайсингом.
Основною реплікативною геліказою бактерій є білок DnaB – кільцевий комплекс шести однакових субодиниць (рис. 10). У каналі всередині кільця розміщується один полінуклеотидний ланцюг, уздовж якого відбувається транслокація гексамеру в напрямку 5′ → 3′ (тобто по ланцюгу, що запізнюється рис. 11), що й призводить до руйнування подвійної спіралі.
Шість субодиниць гелікази мають сайти зв’язування АТР, де відбувається його гідроліз. Структурні перебудови у відповідь на зв’язування та гідроліз АТР змінюють інтерфейс взаємодії з одноланцюговою ДНК, що й приводить до транслокації – на три – п’ять нуклеотидів за один акт гідролізу АТР.
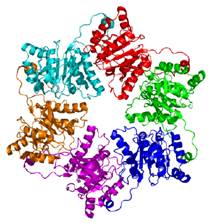
Рис. 10. Структура реплікативної гелікази (1G8Y).
Інші реплікативні гелікази побудовані за аналогічними принципами. У розплітанні ДНК під час реплікації беруть також участь гелікази протилежного напрямку (3′ → 5′– транслокація вздовж лідируючого ланцюга), але, на відміну від DnaB, вони не є життєво необхідними. Геліказа DnaB – це невід’ємний елемент реплісоми, через інші структурні модулі воназв’язана з ДНК-полімеразами та працює в тісній координації з ними.
Швидкість розплітання ДНК окремою геліказою дорівнює ~35 нуклеотидів за секунду, швидкість руху окремої ДНК-полімерази вздовж одноланцюгової ДНК – ~1 тис. нуклеотидів за секунду, при їхньому об’єднанні сумісна швидкість реплікації становить ~750 нуклеотидів за секунду: геліказа трохи гальмує полімеразу, остання – штовхає геліказу.
Енергія гідролізу АТР використовується геліказою для здійснення енергетично невигідного процесу розплітання дуплекса. Тобто одноланцюгова ДНК, що виникає в реплікативній вилці внаслідок активності гелікази, має бути тимчасово стабілізована в одноланцюговому вигляді. Цю функцію виконують білки SSB (Single Strand Binding), які мають високу спорідненість до одноланцюгової ДНК (рис. 11).
SSB білки зв’язуються з полінуклеотидним ланцюгом кооперативно, взаємодіючи не тільки з ДНК, а й між собою. У результаті ланцюг ефективно вкривається білковою «шубою». SSB білки взаємодіють також з іншими компонентами реплісоми, підсилюючи їхню активність у тому числі активність ДНК-полімерази.
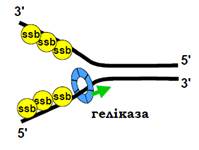
Рис. 11. Реплікативна вилка, що виникає як результат дії гелікази та підтримується SSB білками.
 2017-11-01
2017-11-01 713
713








