Процесс распада вещества электролитов на ионы под действием растворителя или в расплаве называется электролитической диссоциацией.
По наличию или отсутствию электролитической диссоциации растворы низкомолекулярных соединений подразделяют на два класса – растворы электролитов и неэлектролитов.
Электролиты - это вещества, растворы и расплавы которых проводят электрический ток. К ним относятся вещества с ионной и ковалентной полярной связью (соли, кислоты, основания). Электрическая проводимость растворов электролитов выше, чем растворителя.
Неэлектролиты – это вещества, растворы и расплавы которых не проводят электрический ток. К неэлектролитам относятся газообразные вещества, органические вещества: сахар, бензин, спирты, хлороформ, мочевины и др. Электрическая проводимость растворов неэлектролитов мало отличается от растворителя.
 Рис. 12. Сванте Август Аррениус - шведский
Рис. 12. Сванте Август Аррениус - шведский
физико-химик, автор теории
электролитической диссоциации (1887 г.)
Основные положения электролитической диссоциации:
1.Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные (катионы) и отрицательные (анионы).
HCl ↔ Н + + Cl –
NaOH ↔ Na+ + OH–
K2SO4 ↔ 2K+ + SO42–
2.Под действием электрического тока ионы приобретают направленное движение: положительно заряженные частицы движутся к катоду, отрицательно заряженные – к аноду. Поэтому положительно заряженные частицы называются катионами, а отрицательно заряженные – анионами. В обычных условиях ионы (без тока) совершают хаотичные движения.
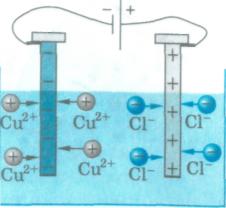 Рис. 13. Направленное движение катионов и
Рис. 13. Направленное движение катионов и
анионов под действием электрического тока.
3.Направленное движение происходит в результате притяжения их противоположно заряженными электродами (катод заряжен отрицательно, а анод – положительно).
4.Ионизация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов в молекулы (ассоциация).
Al2(SO4)3 ↔ 2Al3+ + 3SO42-.
Электролиты делятся на слабые, средние и сильные.
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах. Слабыми электролитами являются:
- почти все органические кислоты и вода;
- некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H2CO3, H2SiO3, H2SO3 и др.;
- некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Электролиты средней силы Н3РО4, НNO3, H2F2.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированны на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.). Сильными электролитами являются:
- кислоты (HCl, HBr, HJ, HNO3, H2SO4, HClO3, HClO4, HMnO4, H2SeO4 и др.);
- основания (NaOH, KOH, LiOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2 и др.);
- все растворимые в воде соли, кроме роданида железа (Ш), хлорида ртути (П), хлората ртути (П).
Таблица 2.
Таблица электролитов и неэлектролитов.
| ЭЛЕКТРОЛИТЫ | НЕЭЛЕКТРОЛИТЫ (α =0) | |
| СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ (α ≈1) | СЛАБЫЕ ЭЛЕКТРОЛИТЫ (α<<1) | Оксиды, не взаимодействующие с водой. Простые вещества. Органические соединения кроме карбоновых кислот. |
| Растворимые соли (в том числе соли органических кислот) | Некоторые малорастворимые и нерастворимые соли | |
| Сильные кислоты (HC1, HI и др.) | Слабые кислоты, в том числе органические (HCOOH, CH3COOH и др.) | |
| Сильные основания – щелочи (NaOH, KOH и др.) | Нерастворимые основания и NH4OH |
Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода. Например,
HNO3 ↔H+ + NO3-
нитрат-ион
Многоосновные кислоты диссоциируют ступенчато. Ступенчатая диссоциация кислот объясняет образование кислых солей. Например, сероводородная кислота диссоциирует ступенчато:
H2S ↔ H+ + HS- (первая ступень)
гидросульфид-ион
HS- ↔ H+ + S2- (вторая ступень)
сульфид-ион
Диссоциация многоосновных кислот протекает, главным образом, по первой ступени. Это объясняется тем, что энергия, которую нужно затратить для отрыва иона от нейтральной молекулы, минимальна и становится больше при диссоциации по каждой следующей ступени – положительная частица отрывается от отрицательнозаряженной частицы, которая хорошо притягивает катион водорода.
 2017-11-01
2017-11-01 4013
4013
