Разбавленная и концентрированная серная кислота обладает различными окислительно-восстановительными свойствами. В разбавленной серной кислоте окислителем является ион водорода, поэтому разбавленная серная кислота взаимодействует только с активными металлами, которые вытесняют из разбавленной серной кислоты водород, и не взаимодействует с малоактивными металлами (смотрите ряд активности – ряд напряжений металлов):
Zn + H2SO4(разб.) → H2 + ZnSO4,
 Cu + H2SO4(разб.) → реакция не протекает
Cu + H2SO4(разб.) → реакция не протекает
В концентрированной серной кислоте окислителем является ион SO 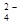 , поэтому концентрированная серная кислота взаимодействует как с активными, так и малоактивными металлами, кроме золота и платиновых металлов. Нужно помнить, что концентрированная серная кислота пассивирует (делает пассивными) некоторые активные металлы, например железо. При взаимодействии металлов с концентрированной серной кислотой водорода не выделяется, металлы восстанавливают ион SO
, поэтому концентрированная серная кислота взаимодействует как с активными, так и малоактивными металлами, кроме золота и платиновых металлов. Нужно помнить, что концентрированная серная кислота пассивирует (делает пассивными) некоторые активные металлы, например железо. При взаимодействии металлов с концентрированной серной кислотой водорода не выделяется, металлы восстанавливают ион SO  до различных состояний в зависимости от активности металла, площади поверхности его соприкосновения с кислотой, концентрации кислоты:
до различных состояний в зависимости от активности металла, площади поверхности его соприкосновения с кислотой, концентрации кислоты:
|
|
|

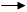 H2S + Н2О+ соль металла и серной
H2S + Н2О+ соль металла и серной
 активный металл + H2SO4(конц.) S + Н2О+ кислоты (сульфат металла)
активный металл + H2SO4(конц.) S + Н2О+ кислоты (сульфат металла)
 SО2 + Н2О+
SО2 + Н2О+
Малоактивный металл + H2SO4(конц.) → SО2 + Н2О + сульфат металла.
При взаимодействии некоторых неметаллов с концентрированной серной кислотой ион SO  восстанавливается до SО2.
восстанавливается до SО2.
Разбавленная и концентрированная азотная кислота взаимодействует с активными металлами, кроме золота и платиновых металлов. В азотной кислоте окислителем является ион NO 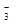 , поэтому при взаимодействии металлов с азотной кислотой водород не выделяется, а образуются различные продукты восстановления иона NO
, поэтому при взаимодействии металлов с азотной кислотой водород не выделяется, а образуются различные продукты восстановления иона NO 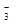 в зависимости от активности металла и концентрации кислоты. Концентрированная азотная кислота пассвирует некоторые активные металлы (алюминий, хром, железо и др.). Реакции протекают по схемам:
в зависимости от активности металла и концентрации кислоты. Концентрированная азотная кислота пассвирует некоторые активные металлы (алюминий, хром, железо и др.). Реакции протекают по схемам:


 NH3 + H2O соль металла
NH3 + H2O соль металла
 NH4NO3 + H2O + и азотной
NH4NO3 + H2O + и азотной


 активный + НNO3(разб.). N2 + H2O кислоты – нитрат металла,
активный + НNO3(разб.). N2 + H2O кислоты – нитрат металла,
металл N2O + H2O
Малоактивный металл + HNО3(разб.). → NO + H2O + нитрат металла.
Активный металл + HNО3(конц.). → NO + H2O + нитрат металла.
Малоактивный металл + HNО3(конц.). → NO2 + H2O + нитрат металла.
При взаимодействии металлов с концентрированной азотной кислотой возможно образование и некоторых других продуктов окисления металлов.
 2017-11-01
2017-11-01 3728
3728
