ЛЕКЦИЯ 11
В производстве серной кислоты образуются твёрдые, жидкие и газообразные отходы.
К твёрдым отходам следует отнести огарок и селеновый шлам при производстве серной кислоты из серы. К жидким отходам следует отнести кислые воды (содержащие серную кислоту). При нормальной работе цеха серной кислоты кислых вод не образуется. Кислые стоки образуются только в аварийных ситуациях при течи холодильников или разрыве трубопроводов. Кислая вода нейтрализуется на стадии известковым молоком или содой.
При производстве серной кислоты из колчедана на 1 т серной кислоты образуется 700-750 кг огарка.
Огарок используется для:
- производства цемента в виде железосодержащего шлака вводится в цементную шихту, что позволяет снизить температуру обжига клинкера, понизить расход топлива и повысить прочность цемента
- производства стекла
- удобрения почв в сельском хозяйстве.
На эти цели используется приблизительно 50% огарка.
Огарок содержит более 50% железа. В нём также содержится медь, цинк, свинец, кобальт, мышьяк, серебро и другие металлы. В настоящее время стоит задача комплексной переработки огарка с получением цветных и благородных металлов.
Комплексная переработка огарка состоит в том, что его подвергают низкотемпературному обжигу в присутствии хлорида натрия, хлора и хлороводорода. После обжига огарок, содержащий хлориды металлов, обрабатывают раствором серной кислоты с переводом в раствор меди, цинка, кобальта и серебра.
Оставшийся твёрдый огарок перерабатывают в доменных печах.
Степень извлечения меди составляет 78%, серебра–72%, цинка–74%, кобальта–51%.
В Японии разработана технология, где из огарка извлекают 14 элементов.
Селеновый шлам – рассмотрен ранее.
Битум, содержащий более 50% серы, при производстве серной кислоты из серы в настоящее время используется в дорожном строительстве. Комплексная переработка битума с извлечением серы является важнейшей задачей, но пока технологии нет.
Газовые выбросы
В технологических схемах производства серной кислоты одинарного контактирования в отходящих газах содержится 0,2% SO2 и приблизительно 0,007% SO3.
По санитарным нормам такие газы нельзя выбрасывать в атмосферу без предварительной очистки.
Ежегодно в мире выбрасывается в атмосферу около 200 млн. тонн SO2 и каждые 20 лет эта цифра удваивается.
50,3 – ТЭУ
20 – автотранспорт
7,4 – цветные металлы
2,3 – нефтепереработка
1,2 – химическая промышленность
0,4 – промышленность стройматериалов.
Существуют следующие основные способы утилизации SO2.
1. Если концентрация SO2 в отходящих газах составляет 4 %, то такие газы можно перерабатывать на серную кислоту по существующим схемам.
2. Поглощение SO2 химическими поглотителями с их последующей регенерацией или с получением ценных химических продуктов.
3. Каталитические способы очистки отходящих газов с получением серной кислоты.
Предельно допустимая концентрация SO2 в зоне производственных помещений составляет 10 мг/м3, SO3 – 1 мг/м3.
Наиболее широкое распространение получили следующие методы:
- сульфит-бисульфитный
- кислотно-каталитический
- магнезитовый
Сульфатно-бисульфитный метод.
SO2+2NH4OH=(NH4)2SO3+H2O
(NH4)2SO4+SO2=2NH4 HSO3
SO3+2NH4OH+H2O=(NH4)2SO4+H2O
Имеющиеся пары кислоты взаимодействуют с аммиачной водой с образованием сульфата аммония.
H2SO4+2NH4OH=(NH4)2SO3+H2O
Сульфит-бисульфитный раствор может использоваться в кожевенном производстве. В последние годы сульфит-бисульфитный раствор нашёл применение как консервант кормов для животных в сельском хозяйстве.
При добавлении в раствор серной кислоты будет образовываться сульфат аммония и чистый SO2.
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2+H2O
Если при поглощении аммиачной водой SO2 в газовой фазе высокое парциальное давление аммиака, то взаимодействие SO2 осуществляется не в растворе, а в газовой фазе с образованием тумана (NH4)2SO3. В промышленности поглощение SO2 осуществляется сульфит-бисульфитным раствором и отношение SO2 и аммиака составляет 0,7%, а рН раствора составляет 5-5,5. По мере понижения рН в раствор вводят NH4OH.
Технологическая схема очистки газов сульфит-бисульфитным способом(рисунок 28).
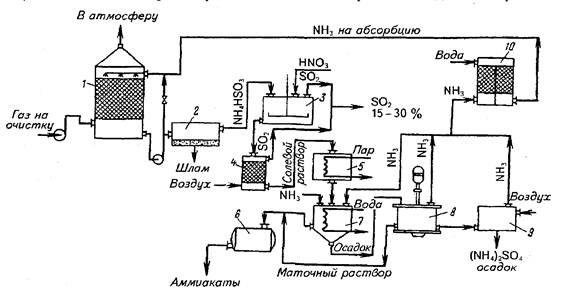
Рисунок 28 - Технологическая схема очистки газов сульфит-бисульфитным способом
1 - распылительный абсорбер, 2 – фильтр, 3 – реактор, 4 – отгонная колонна, 5 – выпарной аппарат, 6 – сборник, 7 – смеситель, 8 – центрифуга, 9 – отдувочный аппарат, 10 – абсорбер поглощения аммиака.
Отходящие газы после абсорбции поступают в распылительный абсорбер, который орошается сульфит-бисульфитным раствором с рН 5-5,5 и отношением SO2:NH3=0,2. В сборник для поддержания постоянного рН вводят 25% раствор NH4OH. Избыточный раствор из цикла абсорбера подаётся в насадочный скрубер, в нижней части которого имеется кипятильник раствора. Нагрев кубовой части осуществляется паром до температуры 103-105°С. В верхнюю часть скрубера подаётся 93% серная кислота и сульфит-бисульфитный раствор разлагается с образованием сульфата аммония и 100% SO2.
100% SO2 возвращается в продувочную колонну серной кислоты, а 40% раствор сульфата аммония перерабатывается на удобрение.
На некоторых предприятиях абсорбцию осуществляют не аммиачной водой, а содой. В этом случае получают раствор сульфит-бисульфита натрия.
Кислотно-каталитический способ очистки.
Он основан на том, что соли марганца в жидкой фазе могут окислять SO2 до серной кислоты. Этот способ можно применить только для очистки отходящих газов, не содержащих другие примеси, например CO2.
2MnO2+3SO2=MnSO3 +MnS2O6
MnS2O6 +H2SO4 =MnSO4 + H2S2O6
H2S2O6=2HSO3
HSO4+O2+2H2O = 2H2SO3+2OH (радикал)
2MnSO4+2OH(-)+H2SO4 = Mn2(SO4)3 + H2O
Mn2(SO4)3 + H2O+ SO2=MnSO4 + 2H2SO4
Технологическая схема(рисунок 29).
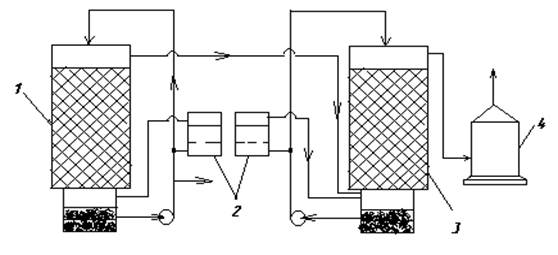
Рисунок 29 - Технологическая схема кислотно-каталитического способа очистки
1 – первый абсорбер, 2 - фильтры, 3 – второй абсорбер, 4 – брызгоуловитель.
Отходящие газы последовательно проходят две насадочные башни. Первая орошается 15-20% раствором серной кислоты, а вторая–5% раствором. Кислота перед орошением последовательно проходит фильтры, где насыщается MnO2. Концентрация MnO2 поддерживается на уровне 0,3-0,1%. Степень очистки составляет 60-70%.
Основной недостаток – это коррозия металла из-за трещин, а также выделяющегося водорода, который восстанавливает серу до сероводорода и при этом резко тормозится реакция окисления SO2 в жидкой фазе до серной кислоты.
Магнезитовый способ
В этом процессе поглотителем служит суспензия MgO.
MgO+ H2O= Mg(OH)2
Mg(OH)2+SO2+5H2O =MgSO3*6H2O
При термическом разложении кристаллогидрат разлагается с образованием SO2.
MgSO3*6H2O= SO2+6H2O+MgO
Технологическая схема магнезитовой очистки отходящих газов(рисунок 30).
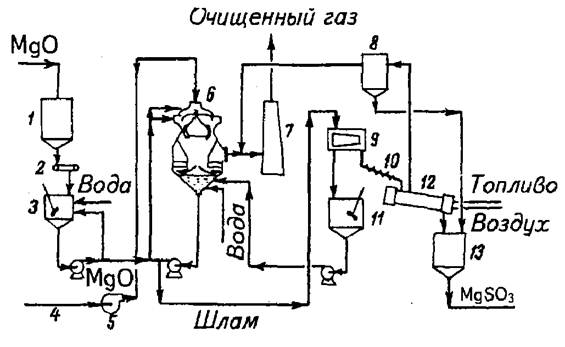
Рисунок 30 - Технологическая схема магнезитовой очистки отходящих газов
1 – бункер с вибратором для хранения MgO, 2 – система весов, 3 –емкость для свежего раствора, 4 – неочищенный дымовой газ, 5 - дымосос, 6 – абсорбер SO2, 7 –дымовая труба, 8 – пылеуловитель, 9 – центрифуга, 10 – конвейер для мокрого кека, 11 – емкость для маточного раствора, 12 – барабанная сушилка, 13 – бункер для хранения MgSO3.
Отходящие газы, содержащие SO2, поступают в абсорбер, который орошают суспензией сульфита гидроксида магния.
ТЭА. 1:10 С(MgO)=180-190 г/л, рН сусп.=6,7-7,2 на выходе и 5,5-5,8 на входе.
Содержание SO2 на выходе 0,03%.
Суспензия, выходящая из абсорбера, частично поступает в сборник, а оставшаяся часть проходит гидроциклоны и фильтр-пресс. Жидкая фаза после ленточного фильтра возвращается в сборник, а кристаллы MgCO3*6H2O поступают в печь кипящего слоя. В нижнюю часть печи подаются топочные газы с температурой 1000°С. На первых двух полках происходит сушка, дегидратация MgCO3*6H2O. Не ост. термическое разложение (750-800°С). Отходящие газы, содержащие 15-18% SO2, перерабатывают на элементарную серу или серную кислоту, а оксид магния идёт в сборник для поддержания концентрации MgO в суспензии 180-190 г/л и рН раствора 7,2-7,3.
Достоинства:
- MgO возвращается в продукт
- оксид магния является дешёвым продуктом и стоимость очистки ниже значения стоимости других способов очистки.
- магнезитовый способом можно поглощать SO2 из отходов газов ТЭУ, которые содержат кроме SO2, сажу. Степень очистки от SO2 при Х=0,2% составляет 75%.
Недостатки: высокий расход энергии на сушку и термообработку сульфата магния.
 2014-02-13
2014-02-13 4306
4306