1. Состояние любого тела характеризуют совокупностью нескольких физических величин, называемых параметрами состояния. Важнейшими параметрами состояния газа являются его объем V, давление р и температура Т.
Состояние газа, при котором все его параметры при неизменных внешних условиях остаются постоянными сколь угодно долго, называют равновесным. Процессы, состоящие из непрерывной последовательности равновесных состояний, называют равновесными. Параметры состояния газов, находящихся в равновесных состояниях, связаны между собой уравнением состояния F (р, V, Т) = 0.
Самый простой вид уравнение состояния имеет для идеальных газов. Идеальными называют газы, молекулы которых взаимодействуют друг с другом лишь при соударениях (отсутствует межмолекулярное притяжение и отталкивание) и объем молекул ничтожно мал по сравнению с объемом, занимаемым газом. Кроме того, предполагают, что соударение молекул происходит по законам абсолютно упругого удара. Реальные газы тем точнее подчиняются законам идеальных газов, чем меньше их давление и выше температура.
2. Для идеальных газов имеют место следующие экспериментальные законы.
Закон Бойля — Мариотта:
 (3.1)
(3.1)
Из этого закона вытекает, что для двух произвольных состояний газа при указанных условиях справедливо равенство:
 (3.1’)
(3.1’)
Закон Гей-Люссака:
 (3.2)
(3.2)
если  и m = const.
и m = const.
Согласно выражению (3.2) при соблюдении указанных ограничений для двух произвольных состояний
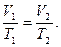 (3.2’)
(3.2’)
Закон Шарля:
 (3.3)
(3.3)
если  и m = const.
и m = const.
Согласно закону Шарля для двух произвольных состояний:
 (3.3’)
(3.3’)
Соотношения (3.1), (3.2) и (3.3) можно рассматривать как уравнения состояния идеального газа соответственно при изотермическом, изобарическом и изохорическом процессах, когда из трех параметров газа изменяются два.
3. Из опытных законов (любых двух) для идеальных газов вытекает объединенный газовый закон (уравнение Клапейрона):
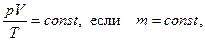 (3.4)
(3.4)
откуда следует, что при переходе газа из одного состояния в другое, когда меняются все три его параметра, должно быть:
 (3.4’)
(3.4’)
4. Молекулярной массой М данного вещества называют массу m х молекулы этого вещества, выраженную в углеродных единицах массы (у.е.м.). За углеродную единицу массы принята 1/12 часть массы m С самого легкого изотопа углерода:

Так же определяют и атомную массу А, но только под m х тогда подразумевают массу атома.
Киломолем называют такое количество вещества, масса которого μ, в килограммах численно равна молекулярной массе (μ = М) этого вещества.
Согласно закону Авогадро в одном киломоле (килоатоме) любого вещества содержится N А=6.02∙1026 молекул (атомов).
При нормальных условиях (р =1.01∙105 н/м2; Т =273 К) один киломоль идеального газа занимает объем υ0=22.4 м3/кмоль.
Если газ с киломолекулярной массой μ имеет массу m и содержит N молекул, то в нем содержится число киломолей ν, равное
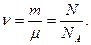 (3.5)
(3.5)
Согласно (3.5) масса одной молекулы

При нормальных условиях объем идеального газа равен
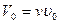 (3.6)
(3.6)
Если в сосуде находится смесь нескольких газов, не вступающих друг с другом в химические реакции, давление смеси газов равно сумме давлений, производимых каждым газом в отдельности, если бы он один занимал весь сосуд (закон Дальтона):

Если за первое состояние принять состояние идеального газа с параметрами р, V, Т, а за второе – его состояние при нормальных условиях, то согласно уравнению (3.4'):

Отсюда с учетом соотношений (3.6) и (3.5):

или
 (3.7)
(3.7)
где величина 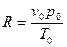
 имеет для всех идеальных газов одинаковое значение и называется универсальной газовой постоянной. Числовое значение газовой постоянной равно:
имеет для всех идеальных газов одинаковое значение и называется универсальной газовой постоянной. Числовое значение газовой постоянной равно:

Уравнение (3.7) называют уравнением Менделеева – Клапейрона. Его можно представить в виде:

где ρ – плотность газа при данной температуре Т, а также

где  – концентрация молекул;
– концентрация молекул;  – постоянная Больцмана.
– постоянная Больцмана.
5. Если температура идеального газа массой m изменяется на Δ T, внутренняя энергия газа изменяется на величину
 (3.8)
(3.8)
где cv – удельная теплоемкость газа при постоянном объеме и сμV – молярная теплоемкость газа при постоянном объеме – теплоемкость, рассчитанная на киломоль газа.
Если при постоянном давлении р газ нагревается от температуры T 1 до температуры T 2, то его объем возрастает от V 1 до V 2 и газ совершает работу
 (3.9)
(3.9)
Применяя уравнение (3.7) для каждого из двух состояний газа, формулу работы можно представить в виде:
 (3.10)
(3.10)
Если в процессе расширения к газу подводится некоторое количество теплоты Q, то согласно закону сохранения и превращения энергии для изобарического процесса
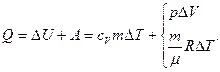 (3.11)
(3.11)
Учитывая (3.8), (3.10) и (3.11) и что
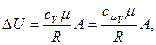 (3.12)
(3.12)
можно записать:
 (3.13)
(3.13)
6. Коэффициент полезного действия идеальной тепловой машины, работающей по циклу Карно, равен:
 (3.14)
(3.14)
где Q 1 и Q 2 – соответственно тепло, полученное от нагревателя и отданное холодильнику, T 1 и Т 2 – температуры нагревателя и холодильника.
 2017-11-01
2017-11-01 965
965








