Один из распространенных случаев электрохимической коррозии - процессы, происходящие при наличии контакта двух металлов, находящихся в растворе электролита. Такую пару металлов (М1 и М2) называют гальванопарой и обозначают М1/М2.
Упрощенное описание коррозионного процесса с участием гальванопар целесообразно выполнять в следующей последовательности.
v Выписать значения потенциалов металлов в данной среде, определить анод (металл – с меньшим значением потенциала) и катод (металл – с бóльшим значением потенциала).
v Выписать значение потенциала возможного окислителя (деполяризатора).
v Оценить возможность процесса сравнением потенциалов окислителя и восстановителя.
v Написать уравнения полуреакций:
анодной – окисления материала анода;
катодной – восстановления окислителя.
v Суммировать уравнения полуреакций, написать ионное и молекулярное уравнения окислительно-восстановительной реакции, протекающей при гальванокоррозии.
v  Указать на условной схеме гальванопары направление перемещения электронов.
Указать на условной схеме гальванопары направление перемещения электронов.
Рассмотрите процесс коррозии луженого (покрытого оловом) железа при условии нарушения сплошности покрытия в кислой среде в отсутствие растворенного кислорода.
Решение.
При условии нарушения сплошности покрытия образуется гальванопара, ее условная схема
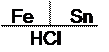 |
v Значения потенциалов металлов
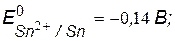
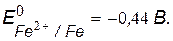
Fe – анод гальванопары (А) – восстановитель, окисляется;
Sn – катод гальванопары (К).
v Возможный окислитель – ионы водорода кислоты, 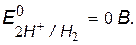
v Сравнение потенциалов окислителя и восстановителя
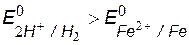 , т.е. коррозия железа возможна.
, т.е. коррозия железа возможна.
v Уравнения полуреакций
 A: Fe - 2ē = Fe 2+ – окисление
A: Fe - 2ē = Fe 2+ – окисление
K(Sn): 2Н+ + 2ē = Н2 – восстановление
 |
v Ионное и молекулярное уравнения:
Fe + 2Н+ = Fe2+ + Н2
Fe + 2НCl = FeCl2 + Н2
v 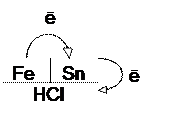 Направление перемещения электронов на условной схеме гальванопары (от участка с меньшим потенциалом к участку с бóльшим потенциалом):
Направление перемещения электронов на условной схеме гальванопары (от участка с меньшим потенциалом к участку с бóльшим потенциалом):
В гальванопаре олово-железо в кислой среде разрушается железо, на олове выделяется водород.
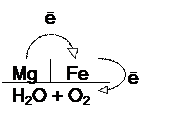
 Рассмотрите процесс коррозии с кислородной деполяризацией во влажном воздухе гальванопары Mg/Fe.
Рассмотрите процесс коррозии с кислородной деполяризацией во влажном воздухе гальванопары Mg/Fe.
Решение.
Условная схема гальванопары
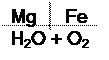 |
v Значения потенциалов металлов
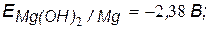
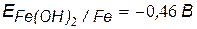 .
.
Mg – анод гальванопары (А) – восстановитель, окисляется.
Fe – катод гальванопары (К).
v Окислитель при коррозии с кислородной деполяризацией – кислород, 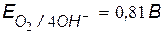 .
.
v 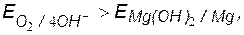 коррозия возможна.
коррозия возможна.
v Уравнения полуреакций

 A: 2 Mg + 2H2O - 2ē = Mg(OH)2 + 2H+ – окисление
A: 2 Mg + 2H2O - 2ē = Mg(OH)2 + 2H+ – окисление
K(Fe): 1 O2 + 2H2O + 4ē = 4OН¯ – восстановление
 |

 2Mg + 4H2O + O2 + 2H2O = 2Mg(OH)2 + 4H+ + 4OH¯
2Mg + 4H2O + O2 + 2H2O = 2Mg(OH)2 + 4H+ + 4OH¯
 4H2O
4H2O
v Молекулярное уравнение:
2Mg + O2 + 2H2O = 2Mg(OH)2
v Направление перемещения электронов на условной схеме гальванопары:
 |
 2014-01-25
2014-01-25 1302
1302
