Природу ионной связи, структуру и свойства ионных соединений можно объяснить электростатическим взаимодействием ионов. Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов. Эту способность можно оценить энергией ионизации и сродством атомов к электрону. Понятно, что легче всего образуют катионы элементы с малой энергией ионизации – щелочные и щелочноземельные металлы. Образование же в условиях обычных химических превращений простых катионов других элементов менее вероятно, так как это связано с затратой большой энергии на ионизацию ионов.
Простые анионы легче всего образуют p-элементы VII группы вследствие их высокого сродства к электрону. Присоединение одного электрона к атомам кислорода, серы, углерода, некоторым другим элементам сопровождается выделением энергии. Присоединение же последующих электронов с образованием свободных многозарядных простых анионов места не имеет, поэтому соединения, состоящие из простых ионов, немногочисленны. Они легче всего образуются при взаимодействии щелочных и щелочноземельных металлов с галогенами. Однако в этом случае электронная плотность между ионами не равна нулю, поэтому можно говорить лишь о преимущественном проявлении ионной связи. Радиусы же одноатомных ионов представляют собой чисто условные величины. Представление об ионных кристаллах – это идеализированная модель.
Ненаправленность и ненасыщаемость ионной связи. Электрические заряды ионов обуславливают их притяжение и отталкивание и в целом определяют стехиометрический состав соединения. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении. Иначе говоря, ионная связь в отличие от ковалентной характеризуется ненаправленностью.
Понятно, что взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей (рис. 3.32). В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, в отличие от ковалентной, ионная связь характеризуется также ненасыщаемостью.
Структура ионных соединений. Вследствие ненапрвленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Однако из-за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной координации ионов.
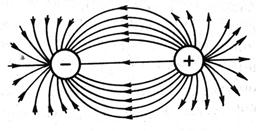
Рис. 3.32. Распределение электрических силовых полей двух разноименных ионов
В отличие от ковалентных соединений координационное число (к.ч.) в «чисто» ионных соединениях не зависит от специфики электронной структуры элементов, а определяется соотношением размеров ионов. Так, при соотношении ионных радиусов в пределах 0,41 – 0,73 имеет место октаэдрическая координация ионов, при соотношении 0,73 – 1,37 – кубическая координация и т.д. Например, при взаимодействии ионов Na+ (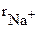 = 0,098 нм) и Cl- (
= 0,098 нм) и Cl- (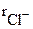 = 0,181 нм), соотношение значений радиусов которых равно 0,54, возникает октаэдрическая координация (рис. 3.33). Подробная взаимная координация ионов достигается при образовании простой кубической кристаллической решетки хлорида натрия. Соотношение ионных радиусов Cs+ (
= 0,181 нм), соотношение значений радиусов которых равно 0,54, возникает октаэдрическая координация (рис. 3.33). Подробная взаимная координация ионов достигается при образовании простой кубической кристаллической решетки хлорида натрия. Соотношение ионных радиусов Cs+ (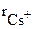 =нм) и Cl- (
=нм) и Cl- (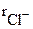 = 0,181 нм) равно 0,91, что соответствует кубической координации (рис. 3.34).
= 0,181 нм) равно 0,91, что соответствует кубической координации (рис. 3.34).
Таким образом, в обычных условиях ионные соединения представляют собой кристаллические вещества.
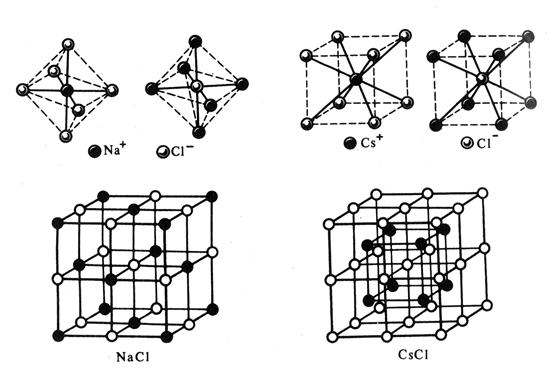
| Рис. 3.34. Структурный тип хлорида цезия CsCl | Рис. 3.33. Структурный тип хлорида натрия NaCl |
 2014-01-27
2014-01-27 1076
1076







