1. Центрифугирование. Под действием центробежной силы появляются «быстрые» частицы и происходит слипание частиц.
2. Коагуляция электрическим током.
Коллоидный раствор пропускают между разнозаряженными металлическими пластинами.
3. Добавка электролита.
Для коагуляции золей электролитами установлен ряд эмпирических закономерностей.
1. Для начала коагуляции золя необходима некоторая минимальная концентрация электролита, называемая порогом коагуляции γ.
2. Коагулирующим действием обладает тот из ионов электролита, заряд которого противоположен заряду коллоидных частиц, причем коагулирующее действие иона тем сильнее, чем больше его заряд. Правило Шульце – Гарди или правило значности: чем выше валентность коагулирующего иона, тем меньше его нужно для коагуляции.
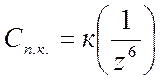
где к- коэффициент, характеризующий дисперсную фазу, дисперсионную среду и структуру ДЭС.
Для одной и той же дисперсной системы соотношение между порогами коагуляции одно, двух и трехзарядных ионов будет таким:
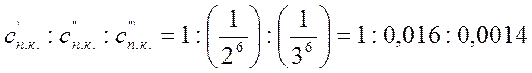
Проще рассчитать порог коагуляции с учетом объема и концентрации электролита, вызывающего коагуляцию.
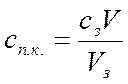
Сз и Vз – концентрация и объем золя.
3. В рядах неорганических ионов с одинаковыми зарядами (лиотропные ряды) коагулирующее действие возрастает с уменьшением гидратируемости ионов; например, в ряду однозарядных катионов щелочных металлов коагулирующее действие возрастает от лития к рубидию:
γ (Li+) > γ (Na+) > γ (К+) > γ (Rb+)
Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц в единице объема за единицу времени. Скорость коагуляции золя электролитами зависит как от концентрации самого золя, так и от концентрации электролитов, а также времени коагуляции.
Концентрацию золя после коагуляции определяют по формуле
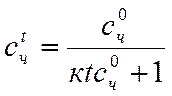
где с0 и сt – численная концентрация до коагуляции (начальная) и после (конечная) соответственно.
Для упрощения формулы величину к•с0ч выражают через время половинной коагуляции Θ. Это время, за которое начальная численная концентрация снизится в два раза. Оно определяется опытным путем.
Отсюда
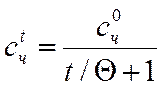
Это формула относится к так называемой быстрой коагуляции (каждое сближение частиц приводит к их слипанию).
Особенности быстрой и медленной коагуляции характеризует константа скорости коагуляции.
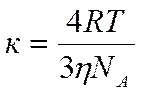
где η – вязкость дисперсионной среды.
Найденная по этой формуле ктеор характеризует быструю коагуляцию. Если соблюдается условие кэкс <ктеор, то имеет место медленная коагуляция.
Электролитическая коагуляция на примере коллоидного раствора Fe(OH)3
Fe (OH)3 получают гидролизом FeCl3 в чистой кипящей воде.
FeCl3 + 3НОН → Fe (OH)3 + 3 HCl
Fe3+ + 3HOH → Fe (OH)3 + 3H+
Образуется коллоидный раствор, так как есть стабилизатор – часть Fe (OH)3 реагирует с HCl
Fe (OH)3 + 3 HCl → FeOCl + H2O
FeOCl → FeO+ + Cl-
Ионы FeO+ легко адсорбируются на коллоидной частице.


 Cl-
Cl-
m Fe (OH)3 FeO+ потенциалопределяющие ионы


FeO+ FeO+ Cl-
Далее на поверхности адсорбируются ионы Cl- , но их меньше чем FeO+ . Остальные ионы располагаются около коллоидной частицы.
А. Коагуляция анионом.
Добавим электролит K2SO4. Он диссоциирует: K2SO4 → 2К+ + SO42-
Коллоидная частица заряжена положительно и поэтому будет собирать вокруг себя ионы SO42- . А ионы К+ отойдут от частицы подальше.


 Cl- ←SO42- К+
Cl- ←SO42- К+
m Fe (OH)3 FeO+


FeO+ FeO+ Cl- ←SO42- К+
Ионы диффузного слоя не могут войти в частицу. Когда за ними оказываются ионы SO42- , они прижимают Cl- к поверхности. Диффузный слой сжимается, часть ионов входит в поверхность и нейтрализует заряд либо полностью, либо в основном. А такие частицы при столкновении слипаются.
Б. Коагуляция катионом.
KI + AgNO3 → AgI ↓ + KNO3
 При избытке KI образуется такая коллоидная частица
При избытке KI образуется такая коллоидная частица

 К+← катион
К+← катион
m AgI I-

 I- I-
I- I-
К+← катион
При прибавлении любого электролита вокруг коллоидной частицы собираются катионы и коагуляция идет аналогично.
Коагуляция электролитами широко используется при очистке воды. Там коллоидные частицы как правило отрицательно заряжены. В качестве электролита берут соли алюминия – Al2(SO4)3 или AlCl3. Вызвав коагуляцию, ионы Al3+ гидролизуются и образуют Al(OH)3, выпадающий в осадок. Свежевыпавший осадок очень хорошо адсорбирует все загрязнения.
4. Коагуляция смесью электролитов.
При использовании смеси электролитов возможны 3 варианта:
1. электролиты в смеси действуют также как и по отдельности, а действие их суммируется. Когда коагулирующие ионы близки по свойствам и особенно по заряду, то они оказывают аддитивное действие.(схожее)
2. электролиты в смеси ослабляют коагулирующее действие друг друга – антагонизм ионов.
3. электролиты в смеси усиливают коагулирующее действие друг друга. Это явление синергизма.
5. Взаимная коагуляция.
Это явление происходит при смешивании двух коллоидных растворов с противоположно заряженными частицами.
Так, смешение золя гидроксида железа, частицы которого имеют положительный заряд, с отрицательно заряженным золем сульфида мышьяка приводит к их взаимной коагуляции:
{[mFe(OH)3] n FeO+· (n-x)Cl–}x+ · xCl– {[ mАs2S3] · n НS–· (n-x)Н+}x– · xН+
В данном случае коагуляция обусловлена тем, что коллоидные частицы одного вида являются как бы очень крупными многозарядными ионами – коагулянтами для частиц другого вида. Взаимная коагуляция коллоидных систем может наблюдаться и тогда, когда частицы золей имеют одноименный заряд; в этом случае причиной потери устойчивости одного из золей является сильная специфическая адсорбция иона – стабилизатора данной системы поверхностью коллоидных частиц другой системы.
6. Старение золей и пептизация (перевод осадка в коллоидный раствор).
Термодинамическая неустойчивость лиофобных коллоидных систем является причиной старения золей – самопроизвольной коагуляции (автокоагуляции) золей. Автокоагуляция золей происходит значительно медленнее, чем коагуляция электролитами. Одной из основных причин старения золей является медленно совершающийся процесс перекристаллизации вещества ядра.
Пептизацией (дезагрегацией) называется процесс расщепления коагулировавшего золя (коагулята) на первичные частицы – процесс, противоположный коагуляции. Пептизация возможна лишь тогда, когда структура частиц в коагуляте не изменена по сравнению с первоначальной (т.е. когда еще не произошло полного сращивания частиц и они слабо связаны друг с другом; иначе говоря - для свежих осадков).
Различают непосредственную и опосредованную пептизацию. Непосредственная пептизация происходит в результате добавления к коагуляту электролита, содержащего потенциалопределяющий ион; в результате его специфической адсорбции на поверхности частиц дисперсной фазы их заряд вновь увеличивается, толщина двойного электрического слоя возрастает. Это приводит к тому, что силы отталкивания между частицами начинают преобладать над силами притяжения; происходит деагрегация – распад образовавшегося ранее агрегата из слипшихся частиц. Опосредованная пептизация вызывается добавлением в систему вещества, химическое взаимодействие которого с поверхностью коагулята приводит к высвобождению потенциалопределяющих ионов.
Рассмотрим на примере коллоидного раствора AgI. Вызовем коагуляцию добавлением любого электролита. При этом выпадет осадок. Добавим ион, который хорошо адсорбируется на слипшейся поверхности частиц. Это либо I- , либо Ag+ , то есть те, что есть в решетке. Скопление таких частиц на поверхности осадка приводит к отталкиванию коллоидных частиц и образованию коллоидного раствора.
 2014-01-31
2014-01-31 1575
1575
