Раздел химии, изучающий количественный состав и количественное соотношение между реагирующими веществами, называется стехиометрией.
ВВОДНАЯ ЛЕКЦИЯ
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная:
1. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов [Текст]: учеб. пособие для вузов / Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др.; Под ред. Ю.А.Ершова. – М.:Высшая школа, 2005. – 560 с.
2. Бабич Л.В. Практикум по неорганической химии [Текст]: учеб. пособие для студентов биолог.-хим. и хим.-биолог. факультетов пединститутов / Л.В.Бабич, С.А.Балезин, Ф.Б.Гликина и др. – Изд.2-е, перераб. – М.: Просвещение, 1983. – 312 с. – 40000 экз.
Дополнительная:
1. Угай Я.А. Общая и неорганическая химия [Текст]: учеб. пособие для студентов вузов, обучающихся по направлению и специальности «Общая и неорганическая химия». – М.: Высшая школа, 1997. – 527 с. – 10000 экз. – ISBN 5-06-003096-2.
2. Глинка Н.Л. Задачи и упражнения по общей химии [Текст]: учеб. пособие для студентов нехимич. специальностей вузов / Н.Л.Глинка, В.А.Рабинович; под ред. В.А.Рабиновича и Х.М.Рубиной. – М.: Интеграл-Пресс, 2002. – 240 с. – ISBN 5-89602-015-5.
Химия - это наука, изучающая вещества, их состав, строение, свойства и взаимные превращения.
Основные положения атомно-молекулярной теории:
1. Все вещества состоят из молекул.
Молекула - это наименьшая частица вещества, обладающая его химическими свойствами.
2. Молекулы состоят из атомов.
Атом - это наименьшая частица элемента, обладающая его химическими свойствами.
Атом состоит из плотного, положительно заряженного ядра и отрицательно заряженных электронов. В целом атом электронейтрален.
Вид атомов с одинаковым зарядом ядра называется химическим элементом.
Атомы, обладающие одинаковым зарядом ядра, но разной массой, называются изотопами.
Так, природный хлор состоит из двух изотопов: 35Cl и 37Cl.
3. Молекулы и атомы находятся в непрерывном движении.
4. При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы при химических реакциях не изменяются.
Вещества, молекулы которых состоят из атомов одного элемента - называются простыми веществами. Простые вещества могут иметь несколько аллотропных модификаций, т.е. вещества состоят из атомов одного и того же элемента, но обладают разными свойствами.
Сложными веществами называются вещества, молекулы которых состоят из разных элементов и в разных соотношениях.
Единицей измерения количества вещества в химии является моль.
Мольвещества - это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов) сколько содержится атомов в 12 г изотопа углерода 12С.
NA = 6,02×1023
Молярная (мольная) масса - это масса одного моль вещества (М).
[М] = [г / моль]
М Н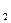 О = 18 г / моль, М NaOH = 40 г / моль
О = 18 г / моль, М NaOH = 40 г / моль
Молярный (мольный) объём - это объём одного моля газообразного вещества (Vм).
При нормальных условиях Vм = 22,4 л
Нормальные условия: p= 101325 Па, Т = 273К
ЗАКОН СОХРАНЕНИЯ МАССЫ.
Массы веществ, вступающих в реакцию, равны массе веществ, получающихся в результате реакции.
ЗАКОН ПОСТОЯНСТВА СОСТАВА.
Каждое сложное вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. Следовательно, химические вещества взаимодействуют друг с другом в строго определенных (эквивалентных) соотношениях.
Эквивалент - это реальная или условная частица вещества, которая может присоединять, замещать, высвобождать один ион водорода в кислотно-основных и ионообменных реакциях или один электрон в окислительно-восстановительных реакциях.
Молярная масса эквивалентов - это масса одного моль эквивалентов, содержащая 6,02×1023 эквивалентов (Э).
[Э] = [г / моль×экв]
Эквивалент зависит от условий протекания реакций, а молярная масса - постоянна.
 2014-01-31
2014-01-31 846
846








